سولفات آهن چیست؟ | همه چیز درباره سولفات آهن
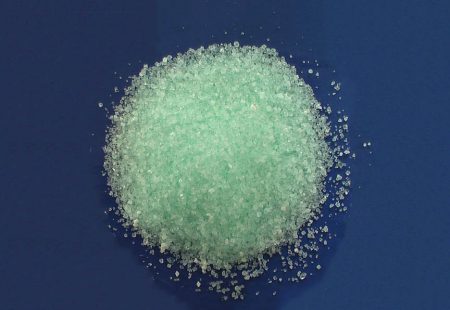
سولفات آهن (II)، آهن (II) سولفات یا فِروس سولفات، به طیف گستردهای از نمکها را با فرمول شیمیایی FeSO4. X H2O نشان میدهد. این ترکیبات معمولاً به عنوان هپتاهیدراته وجود دارند (۷=x) اما برای آن، برای متغیر x، چند مقدار معرفی شده است. از فرم هیدراته آن برای درمان کمبود آهن و همچنین برای مصارف صنعتی استفاده میشود.
فروس سولفات هپتاهیدراته آبی – سبز رنگ است (هپتا هیدراته یعنی ۷ مولکول آب دارد). رایجترین شکل این ماده از دوران باستان و به عنوان ویتریول سبز (= نامی قدیمی است) شناخته شده است. تمام انواع سولفات آهن (II) در آب حل میشوند و همان کمپلکس آکوا یا آبدار، ۲+[Fe(H۲O)۶] را تشکیل میدهند که شکل هندسی آن، مولکول هشت وجهی است و خاصیت مغناطیسی دارد.
فهرست مطالب
نگاهی به تاریخچه سولفات آهن
سولفات آهن، سولفات آهن (II) در دوران باستان، copperas یا زاج سبز نامیده میشد. از نظر تاریخی، از copperas در کاربردهایی مانند سیاه کردن چرم، به عنوان ماده تثبیت کننده رنگ در صنعت نساجی و به عنوان ماده تهیه جوهر استفاده میشد.
در حدود ۷۰۰ سال پیش، برای تهیه اسید سولفوریک (روغن ویتریول) از روش تقطیر ویتریول سبز استفاده میشد. البته امروز بیشتر به کاربردهای مدرن این ماده شیمیایی اهمیت بیشتری داده میشود. بنابراین ابتدا، بهتر است که در این قسمت به طور مختصر، در مورد ترکیب فروس سولفات یا زاج سبز، خواص و کاربردهای آن صحبت کنیم.
پودر زاج سبز چیست و ساختار مولکولی آن چگونه است؟
سولفات آهن (II) یک ماده شیمیایی به رنگ سبز آبی است که در بسیاری از کاربردها از جمله داروسازی، تولید جوهر و رنگ و همچنین کشاورزی مورد استفاده قرار میگیرد. زاج سبز، حالتهای مختلف هیدراتاسیون دارد و چند نوع از این اشکال نیز در طبیعت یافت میشوند. ترکیبات زیر، رایجترین اشکال معدنی از فروس سولفات هستند:
(ملانتریت، سبز آبی) FeSO4.7H2O
(روزنیت، سفید رنگ؛ این ترکیب میتواند یک محصول کم آب با فرم ملانتریت باشد) FeSO4.4H2O
این ساختارهای معدنی نسبتاً نادر هستند:
سیدریتول – (Siderotil (FeSO4.5H2O
فرو هگزا هیدریت – (Ferrohexahydrite (FeSO4.6H2O
زومولنوکیت – (Szomolnokite (FeSO4.H2O
 انتشار آگهی خرید و فروش مواد شیمیایی
انتشار آگهی خرید و فروش مواد شیمیایی

روشهای تولید سولفات آهن
برای دانستن اینکه سولفات آهن چیست، بهتر است روشهای تولید این ماده را بدانیم. یکی از روشهای تولید سولفات آهن، فرآیند آبکاری فولاد است که این ترکیب شیمیایی معدنی را به صورت محصول جانبی تولید میکند. در پایان فرآیندهای تولید فولاد، قبل از آبکاری یا پوشش دهی، ورق یا میله فولاد از “حمام اسید سولفوریک” عبور داده میشود. این تیمار، مقادیر زیادی سولفات آهن (II) را به عنوان محصول جانبی تولید میکند.
Fe + H2SO4→ FeSO4+ H2
در روش دیگر، همچنین این ماده از طریق فرآیند اکسیداسیون پیریت به صورت تجاری تهیه میشود:
2FeS2 +7 O2 +2 H2O →۲ FeSO4 +2 H2SO4
این واکنش میتواند با جابجایی فلزات کمتر واکنش پذیر نسبت به آهن، از محلولهای سولفات آنها انجام شود:
CuSO4+ Fe → FeSO4+ Cu
واکنشها در تولید سولفات آهن
با گرم شدن محلول کمپلکس فروس سولفات، سولفات آهن (II) ابتدا آب تبلور خود را از دست میدهد و بلورهای اصلی سبز رنگ، به یک ماده جامد بی آب، با رنگ سفید، تبدیل میشوند. با ادامه گرم شدن، ماده بی آب، ترکیبات دی اکسید گوگرد و دود سفید اکسید گوگرد را آزاد میکند و اکسید آهن (III) قهوهای مایل به قرمز باقی میماند.
تجزیه سولفات آهن (II) از حدود ۶۸۰ درجه سانتیگراد (۱۲۵۶ درجه فارنهایت) شروع میشود.
2FeSO4 → Fe2O3 + SO2 + SO3
مانند تمام نمکهای آهن (II)، آهن (II) سولفات نیز یک عامل کاهنده است. به عنوان مثال، اسید نیتریک را به مونوکسید نیتروژن و کلر را به کلرید کاهش میدهد:
6FeSO4 +3 H2SO4 +2 HNO3 →۳ Fe2 (SO4) 3 +4 H2O +2 NO
6FeSO4 +3 Cl2 →۲ Fe2 (SO4) 3 +2 FeCl3
فِروس سولفات با قرار گرفتن در معرض هوا، اکسید میشود و یک پوشش خورنده به رنگ زرد قهوهای از “سولفات فریک” را ایجاد میکند که یک ترکیب اضافی از اکسید آهن (III) و آهن (III) سولفات است:
12FeSO4 +3 O2 →۴ Fe2 (SO4) 3 +2 Fe2O3
خواص و کاربردهای سولفات آهن
کاربردهای سولفات آهن چیست؟ سولفات آهن (II) را میتوان در حالتهای مختلف هیدراتاسیون یافت و چندین ساختار از این نوع در طبیعت وجود دارد. این ساختارها را در قسمت زیر مشاهده میکنید:
FeSO4 · H2O
(ماده معدنی: Szomolnokite، نسبتاً نادر)
FeSO4 · 4H2O
(ماده معدنی: روزنیت، سفید، نسبتاً متداول، ممکن است محصول دهیدراتاسیون ملانتریت باشد)
FeSO4 · 5H2O
(ماده معدنی: سیدروتیل، نسبتاً نادر)
FeSO4 · 6H2O
(ماده معدنی:Ferrohexahydrite ، نسبتاً نادر)
FeSO4 · 7H2O
(ماده معدنی: ملانتریت، سبز آبی، نسبتاً رایج)
ساختار تتراهیدراته این ترکیب با رسیدن دمای محلولهای آبی به ۶/۵۶ درجه سانتیگراد (۹/۱۳۳ درجه فارنهایت) تثبیت میشود. این محلولها در دمای ۶۴.۸ درجه سانتیگراد (۱۴۸.۶ درجه فارنهایت)، هم فرم تتراهیدراته و هم مونوهیدراته را تشکیل میدهند.
تمام ساختارهای معدنی ذکر شده با نحوه اکسیداسیون بسترهای سنگ آهن (پیریت، مارکازیت، کالکوپیریت و …) و محیطهای مرتبط (مانند موقعیت آتش سوزی ذغال سنگ) مرتبط هستند. بسیاری از این ساختارها، سریعاً آب خود را از دست میدهند و گاهی اکسیداسیون رخ میدهد.
جدول مشخصات فیزیکی و شیمیایی سولفات آهن
| نام ترکیب | |
| IUPAC نامگذاری Iron(II) sulfateآهن (II) سولفات |
|
| نامهای متداول دیگر: آهن (II) سولفات / Iron(II) sulphate فروس سولفات/ Ferrous sulfate ویتریول سبز / Green vitriol ویتریول آهن / Iron vitriol کوپراس / Copperas ملانتریت / Melanterite زومولنوکیت / Szomolnokite |
|
| شاخصهای شناسایی | |
| فرم بدون آب: ۷۷۲۰-۷۸-۷ فرم مونوهیدراته: ۱۷۳۷۵-۴۱-۶ فرم هفت آبه (هپتا هیدراته) : ۷۷۸۲-۶۳-۰ |
CAS Number |
| فرم بدون آب: ۲۳۱-۷۵۳-۵ | EC Number |
| فرم بدون آب: ۲۴۳۹۳ فرم مونوهیدراته: ۶۲۷۱۲ فرم هفت آبه (هپتا هیدراته): ۶۲۶۶۲ |
PubChem CID |
| ۳۰۷۷ | UN number |
| ویژگیها و خواص | |
| FeSO۴ | فرمول شیمیایی |
| ۱۵۱.۹۱ g/mol (فرم بدون آب) 169.۹۳ g/mol (فرم مونوهیدراته) 241.۹۹ g/mol (فرم پنتا هیدراته) 260.۰۰ g/mol (فرم هگزا هیدراته) 278.۰۲ g/mol (فرم هپتا هیدراته) |
جرم مولی |
| کریستالهای سفید (فرم بدون آب) کریستالهای سفید مایل به زرد (فروم مونو هیدراته) کریستالهای سبز – آبی (فرم هپتا هیدراته) |
شکل ظاهری |
| ۳.۶۵ g/cm۳ (فرم بدون آب) 3 g/cm۳ (فروم مونو هیدراته) 2.۱۵ g/cm۳ (فرم پنتا هیدراته) 1.۹۳۴ g/cm۳ (فرم هگزا هیدراته) 1.۸۹۵ g/cm۳ (فرم هپتا هیدراته) |
دانسیته |
| ۶۸۰ °C (1,256 °F; 953 K) (فرو بدون آب) تجزیه میشود 300 °C (572 °F; 573 K) (فرم مونو هیدراته) تجزیه میشود 60–۶۴ °C (140–۱۴۷ °F; 333–۳۳۷ K) (فرم هپتا هیدراته) تجزیه میشود |
نقطه ذوب |
|
ساختار مونو هیدراته: |
حلالیت در آب |
|
بسیار جزئی در الکل حل میشود |
حلالیت در الکل |
|
۶.۴ g/100 g (20 °C) |
حلالیت در اتیلن گلایکول |
|
۱.۹۵ kPa (فرم ۷ آبه) |
فشار بخار |
| ویژگیهای ساختاری | |
| اورتورومبیک, oP24 (فرم بدون آب) مونوکلینیک, mS36 (فرم مونو هیدراته) مونوکلینیک, mP72 (تترا هیدراته) تری کیلینیک, aP42 (5 آبه) مونوکلینیک, mS192 (هگزا هیدراته) مونوکلینیک, mP108 (7 آبه) |
ساختار کریستالی |
| ترموشیمی | |
| ۱۰۰.۶ J/mol·K (فرم بدون آب) 394.۵ J/mol·K (ساختار ۷ آبه) |
ظرفیت حرارتی (C) |
| ۱۰۷.۵ J/mol·K (فرم بدون آب) 409.۱ J/mol·K (ساختار ۷ آبه) |
آنتروپی استاندارد مولی (So۲۹۸) |
| −۹۲۸.۴ kJ/mol (فرم بدون آب) −۳۰۱۶ kJ/mol (ساختار ۷ آبه) |
آنتالپی استاندارد تشکیل (ΔfH⦵۲۹۸) |
| −۸۲۰.۸ kJ/mol (فرم بدون آب) −۲۵۱۲ kJ/mol (ساختار ۷ آبه) |
انرژی آزاد گیبس (ΔfG˚) |
| ترکیبات مرتبط | |
| سولفات کبالت (II) Copper(II) sulfateسولفات مس (II) Manganese(II) sulfateسولفات منگنز (II) Nickel(II) sulfateسولفات نیکل (II) |
کاتیونها |
| Iron(III) sulfateسولفات آهن (III) | سایر ترکیبات مرتبط |
کاربردهای سولفات آهن
۱- کاربرد سولفات آهن در داروسازی
صنعت دارو و داروسازی، از جمله کاربردهای مهم آهن (II) سولفات است. کمبود آهن، رایجترین مشکل تغذیهای در اکثر افراد است. به عنوان مثال، ورزشکاران، زنان جوان، گیاهخواران و افراد مسن، بیشتر از سایر افراد دچار کمبود آهن یا فقر آهن میشوند. همراه با مصرف مواد غذایی غنی از آهن، مصرف مکملهای حاوی آهن سولفات هم میتواند به جبران این کمبود کمک کند. فقر آهن موجب کم خونی میشود. آهن موجود در خون به انتقال اکسیژن در بدن انسان کمک میکند.
۲- کاربرد زاج سبز در تولید ترکیبات رنگزا و رنگدانه ها
سولفات آهن به عنوان عامل رنگزا استفاده میشود. فروس سولفات در ساخت انواع جوهر مورد استفاده قرار میگیرد. در قرون وسطی تا اواخر قرن هجدهم از این ترکیبات در تهیه جوهر استفاده میشد. آزمایشهای شیمیایی بر روی حروف Lachish (588–۵۸۶ قبل از میلاد) وجود احتمالی آهن را نشان داده است. علاوه بر این فروس سولفات همچنین در رنگرزی پشم استفاده میشود.
دو روش مختلف برای استفاده مستقیم رنگ نیلی در انگلستان در قرن هجدهم توسعه داده شد و تا قرن نوزدهم نیز مورد استفاده قرار گرفت. به عنوان مثال، یکی از این موارد که به رنگ “آبی چینی” معروف است، شامل آهن (II) سولفات است.
از زاج سبز امروزه نیز به عنوان ماده رنگی در مواد غذایی و رنگهای پارچهای استفاده میشود. این رنگ با سایر رنگها ترکیب و مخلوط میشود:
- ترکیب با رنگدانه درخت انار برای ایجاد یک سبز زیتونی تیره
- ترکیب با Madder (یک گیاه اوراسیا) برای ایجاد یک بنفش مایل به خاکستری تیره
- ترکیب با تانن برای ایجاد بنفش خاکستری
- ترکیب با شاه بلوط برای ایجاد رنگ خاکستری متوسط
۳- کاربرد سولفات آهن (II) در کشاورزی برای رشد گیاهان
سولفات آهن به عنوان یک اصلاح کننده خاک در نقش یک کود سولفاته غنی از آهن، استفاده میشود؛ همانند سولفات آلومینیوم، کود زاج سبز نیز به عنوان یک اصلاح کننده بافت خاک برای کاهش pH در خاکهای بسیار قلیایی استفاده میشود تا گیاهان بتوانند به راحتی به مواد مغذی خاک دسترسی پیدا کنند.
در باغبانی از این ماده برای معالجه کلروز آهن (زردی برگهای گیاه، ناشی از کمبود آهن) استفاده میشود. باغداران و کشاورزان آن را با کمپوست مخلوط کرده و در خاک دفن میکنند تا به عنوان یک منبع غنی، تا سالها دوام داشته باشد. همچنین ممکن است از آن به عنوان عامل نرم کننده چمنها و برای از بین بردن خزه استفاده کنند.
نحوه مصرف کود سولفات آهن برای هر گیاه متفاوت است و بستگی به شرایط خاک و نوع گیاه و شرایط اقلیمی دارد.
۴- کاربرد در حذف فسفر و کاهش رنگ در فاضلاب
سولفات آهن یک عامل منعقد کننده گزینشی (انتخابی) برای بسیاری از کاربردهای تصفیه فاضلاب صنعتی و بهداشتی است. آهن (II) سولفات به دلیل کارآیی بالا، تأثیر در شفاف سازی و کاربرد به عنوان ماده آبگیری لجن، عامل انعقاد در اکثر فرآیندهای تصفیه فاضلاب صنعتی و بهداشتی است مصرف میشود. تیمار با محلولی از این ترکیب با غلظت خاص، فرآیند حذف مواد جامد معلق و رنگ از آب را موجب میشود که به صورت انعقاد رخ میدهد. چند فاکتور مهم در تصفیه آب اهمیت دارد که عبارتند از: TSS، FOG ، BOD و COD.
۵- سایر کاربردهای آهن (II) سولفات
- عامل تثبیت در صنعت عکاسی برای ظاهر کردن تصاویر
- به جریان آب در تجهیزات خنک کننده اضافه میشود تا از طریق لولههای برنجی کندانسورهای توربین به جریان در آید و یک پوشش محافظ مقاوم در برابر خوردگی را تشکیل دهد.
- در تصفیه طلا برای رسوب طلای فلزی از محلولهای کلرید طلا (طلای محلول، مخلوطی از اسید نیتریک و اسید کلریدریک)
- کاربرد به عنوان معرف در شناسایی قارچها
- به عنوان یک کاتالیزور آهن جزئی از معرف Fenton؛ یک کاتالیزور برای اکسید کردن آلایندهها یا پسابهای آب
- عامل کف کننده در نوشیدنیهای الکلی
- گاهی اوقات به عنوان ماده رنگزای مصنوعی در کنسرو زیتون سیاه مصرف میشود
- برای لکه گیری بتن و برخی سنگهای آهکی و ماسه سنگها که به رنگ زرد (=زنگ آهن) مایل به زرد معمولی استفاده میشود
- در کارگاه چوب، از محلولهای سولفات آهن برای رنگ آمیزی چوب افرا به رنگ نقرهای استفاده میشود
ایمنی سولفات آهن
ترکیب آهن (II) سولفات یا پودر زاج سبز، به خودی خود، سمی و خطرناک نیست اما همانند سایر ترکیبات شیمیایی جامد باید موارد احتیاط و ایمنی را رعایت نمود. بهتر است هنگام کار با این ترکیب از دستکش، عینک و ماسک استفاده کنید که غبارات منتشر شده در هوا، به سیستم تنفسی شما وارد نشوند.
در صورت تماس با پوست یا چشمها به شدت تحریک کننده است؛ در این صورت اگر علائم آلرژی شدید شد حتماً باید مصدوم را به پزشک برسانید. قبل از این کار میتوانید محل تماس با ترکیب آهن (II) سولفات را با آب بشویید.
آهن (II) سولفات، قابل اشتعال یا قابل انفجار نیست اما بهتر است آن را در انبارهایی نگهداری کنید که دارای تهویه خوب بوده و مواد قابل احتراق در آنجا نباشد.
شرایط نگهداری سولفات آهن چیست؟
کیسههای حاوی ترکیب آهن (II) سولفات باید دارای برچسبهای ایمنی و اطلاعات محصول باشند. این موارد همان نکاتی هستند که در برگه اطلاعات ایمنی محصول یعنی MSDS نوشته شده است.
بسته بندیهای فروس سولفات را از مواد ناسازگار جدا نگه دارید. همه کارگران انبار باید از تجهیزات محافظ شخصی مناسب استفاده کنند.
ظروف و مخازن یا کیسههای ذخیره سازی انبوه آهن (II) سولفات و سیستمهای دیگر که با این ترکیب سروکار دارند باید از نظر ابعاد و اندازه استاندارد باشند و درب آنها پس از هر استفاده، محکم بسته شود.
کیسهها یا مخازنی از جنس پلی اتیلن، پلی پروپیلن، فایبرگلاس، برای ذخیره و نگهداری این محصول جامد، مناسب هستند.
بسته بندیهای حاوی آهن (II) سولفات باید در انبارهای خشک و خنک و دارای تهویه عالی نگهداری و ذخیره شوند. علامت گذاری و برچسب گذاری مناسب برای جلوگیری از حوادث، ضرورت دارد.
برخی غلظتهای این محصول در دمای پایین، منجمد شده یا متبلور میشوند، بنابراین عایق بندی بستهها یا مخازن، پمپها، لولهها و تجهیزات جانبی الزامی است.
محصول باید طی یک سال استفاده شود. ظروف مخصوص نگهداری این مواد ممکن است در صورت خالی بودن نیز خطرناک باشد، زیرا بقایای محصول (بخار، مایع) را در خود حبس میکنند.
بسته بندی سولفات آهن
بسته بندی سولفات آهن چیست؟ بسته بندی فریک سولفات و سولفات آهن (III) به عنوان دو ترکیب شناخته شده از فروس سولفات، به صورت کیسههای ۲۵ کیلوگرمی یا پالت ۱ تنی ارائه میشود. بسته به درخواست مشتری برای خرید سولفات آهن، زاج سبز، امکان حمل فلهای نیز با رعایت استانداردها، امکان پذیر است.

وضعیت بازار و خرید و فروش سولفات آهن
در بازار خرید و فروش مواد اولیه صنعتی، سولفات آهن (II) و سولفات آهن (III)، رایج و پرکاربرد هستند. این ترکیب با خلوص ۱۸% و ۲۰% در بازار موجود است. هر یک برای مصارف خاص به کار میروند. سولفات آهن کریستالی ( فِروس سولفات ۷ آبه)، خلوص ۱۸% دارد و سولفات آهن پودری ( فِروس سولفات ۴ آبه) دارای خلوص ۲۰% است.
مصرف کود زاج سبز برای کشاورزی، یکی از متداولترین کاربردهای این ماده است. تأمین ریزمغذیها برای رشد گیاه باعث شده تقاضا برای این ماده در بازار در گروه کودهای کشاورزی، بسیار زیاد باشد. بنابراین حجم خرید و فروش رو به افزایش است.
قیمت آهن (II) سولفات با توجه به تغییرات قیمت مواد اولیه برای تولید، تغییرات قیمت بازار، قیمت ارز و میزان تقاضای مشتری برای خرید، تعیین میشود.
 انتشار آگهی خرید و فروش سولفات آهن
انتشار آگهی خرید و فروش سولفات آهن
منابع:
https://en.wikipedia.org/wiki/Iron(II)_sulfate
https://www.affinitychemical.com/ferrous-sulfate-composition-and-uses/
https://www.kirbyagri.com/downloads/fertilizer-sheets/FERROUS%۲۰SULFATE%۲۰pdf
آخرین دیده شده ها
















دیدگاه کاربران
برنامه کوددهی درخت انگور: راهنمای جامع برای تاکستان داران
جدول برنامه کوددهی درخت گردو: راهنمای جامع ماهانه
جدول برنامه کوددهی درخت پسته: راهنمای جامع ماه به ماه
جدول کوددهی درختان میوه در تابستان: راز باغ های پربار
بهترین کود پتاسیم برای درخت زردآلو: راز میوههای طلایی و باغی پربار
کاشت هندوانه بدون مصرف آب؛ معجزه ای در دل کویرهای ایران
جدول زمان سمپاشی درختان میوه: راهنمای جامع برای باغبانی در سال ۱۴۰۴
کود تابستانه درختان: راهنمای جامع انتخاب بهترین کودها برای رشد بهینه
۵ روش علمی و سنتی برای گرفتن تلخی زیتون
گرما زدگی در گیاهان و درختان: راهنمای جامع پیشگیری و درمان تنش گرمایی
استخراج طلا از بردهای الکترونیکی: راهنمای جامع
کاربرد جوش شیرین (بی کربنات سدیم) در باغبانی و کشاورزی
گیلسونایت چیست؟ ویژگیها، خواص و کاربرد قیر معدنی
سولفات منیزیم چیست؟ خواص، روش تولید و کاربردهای منیزیم سولفات
همه چیز درباره هیدروکلریک اسید | دسترسی به قیمت روز اسید کلریدریک
همه چیز درباره بنتونیت (bentonite)
همهچیز درباره کود فسفاته دی آمونیوم فسفات| DAP
پرمنگنات پتاسیم | ویژگیها، روش تولید و کاربردهای آن
نمک صنعتی: روش تولید و کاربردهای کلرید سدیم
سود مایع چیست؟ همه چیز درباره سود سوزآور مایع
مونو اتیلن گلایکول| روش تولید، ویژگیها و کاربردهای MEG
همه چیز درباره متانول و ۹ کاربرد اصلی این ماده
نشادر چیست؟ | خواص، کاربردها و بازار خرید و فروش کلرید آمونیوم
کود معدنی، راهکاری برای کشاورزی پایدار و سودزا