همه چیز درباره اسید سولفوریک

فهرست مطالب
اطلاعاتی اولیه درباره اسید سولفوریک
اسید سولفوریک (هیدروژن سولفات یا جوهر گوگرد) که به عنوان “روغن ویتریول” نیز شناخته میشود، یک اسید معدنی است که از عناصر گوگرد، اکسیژن و هیدروژن تشکیل شده است. فرمول شیمیایی آن به صورت H2SO4 نوشته میشود.سولفوریک اسید، مایعی بی رنگ، بی بو و چسبناک است که در آب، محلول است و از طریق واکنشهایی که بسیار گرمازا هستند، سنتز میشود.
خاصیت خورندگی این اسید نسبت به مواد دیگر را میتوان به خاصیت اسیدی قوی آن نسبت داد؛ و اگر در غلظت بالا وجود داشته باشد، در کنار خاصیت اکسید کنندگی، آب را نیز جذب میکند. این ماده همچنین جاذب رطوبت است و بخار آب را به راحتی از هوا جذب میکند. در اثر تماس با بافت زنده، اسید سولفوریک میتواند باعث سوختگی شدید شیمیایی و حتی سوختگی ثانویه به دلیل کم آبی شود. حتی در غلظتهای پایین نیز بسیار خطرناک است!
سولفوریک اسید صنعتی یک ماده شیمیایی بسیار مهم است. تولید این ماده در یک کشور، شاخص خوبی برای تعیین توانایی صنایع آن کشور به شمار میرود. این ماده یک ماده اصلی در صنایع شیمیایی است. این ماده معمولاً در ساخت کود کشاورزی استفاده میشود اما در فرآوری مواد معدنی، تصفیه روغن، فرآوری فاضلاب و سنتز بسیاری از ترکیبات شیمیایی نیز به کار میرود.
یک طیف گسترده از کاربردهای سولفوریک اسید، استفاده از آن برای تولید محلولهای پاک کننده برای جرم گیری و تخلیه فاضلاب خانگی است. این اسید همچنین به عنوان یک الکترولیت در باتریهای سرب – اسید، در آبگیری از یک ترکیب و … به کار میرود. سایر موارد کاربردی این اسید را در ادامه بحث بیان میکنیم.
 انتشار آگهی خرید و فروش
انتشار آگهی خرید و فروش
نگاهی به تاریخچه اسید سولفوریک (هیدروژن سولفات)
برای دانستن همه چیز درباره هیدروژن سولفات در ابتدا بهتر است با تاریخچه این ماده آشنا شوید. مطالعه در مورد ویتریول (Vitriol)، دستهای از مواد معدنی با ظاهر شیشهای که میتوان از آن اسید به دست آورد، در دوران باستان آغاز شد. “سومریان” لیستی از انواع ویتریول داشتند که آنها را بر اساس رنگ، طبقهبندی میکردند.
برخی از گزارشهای اولیه در مورد منشأ و خصوصیات ویتوریول در آثار پزشک یونانی دیوسکوریدس (قرن اول میلادی) آمده است. جالینوس همچنین در مورد کاربرد پزشکی آن بحث کرده است.
کیمیاگران جهان اسلام در دوران قرون وسطی، جابر بن حیان (۷۲۱ – ۸۱۵ میلادی)، محمد بن زکریای رازی (۸۶۵ – ۹۲۵ میلادی)، ویتریول را در لیست طبقه بندی مواد معدنی خود قرار دادهاند. ابن سینا بر کاربردهای پزشکی و انواع مختلف ویتریول تمرکز داشت. رازی اولین فردی است که اسید سولفوریک تولید میکند.
در قرن هفدهم، یوهان گلاوبر، شیمی دان آلمانی-هلندی، این ماده را با سوزاندن گوگرد همراه با نمک نیترات پتاسیم، KNO3، در حضور بخار تهیه کرد.
با تجزیه شدن نمک نیترات پتاسیم، گوگرد به SO3 اکسید میشود که در اثر ترکیب با آب، هیدروژن سولفات، تولید میشود. در سال ۱۷۳۶، جوشوا وارد (Joshua Ward)، داروسازی اهل لندن، با استفاده از این روش اولین تولید انبوده هیدروژن سولفات را آغاز کرد.
در سال ۱۷۴۶ در بیرمنگام ، “جان روبوک” این روش را برای تولید هیدروژن سولفات در محفظههای سرب دار مقاوم، ارائه کرد. این محفظهها محکمتر و ارزانتر بودند و حتی میتوانست بزرگتر از ظروف شیشهای مورد استفاده در روشهای قبلی باشد.
این فرایند، امکان تولید صنعتی اسید سولفوریک را فراهم میکند. پس از چندین بار تصفیه، این روش که فرآیند محفظه سرب یا “فرآیند محفظه” نامیده میشود، تقریباً برای دو قرن در تولید استاندارد هیدروژن سولفات استفاده میشد.
سولفوریک اسید تولید شده توسط فرآیند “جان روبوک” به غلظت ۶۵٪ نزدیکتر بود. اصلاحات بعدی در فرآیند اتاق سرب توسط شیمیدان فرانسوی “جوزف لوئیس گیلوساک” و شیمی دان انگلیسی، “گلوور” باعث بهبود غلظت اسید در حدود ۷۸٪ شد.
با این حال، تولید برخی از رنگها و سایر فرآیندهای شیمیایی به محصول غلیظتری از اسید سولفوریک نیاز دارد.
در سال ۱۸۳۱ ، بازرگان بریتانیایی سرکه، Peregrine Phillips، فرآیند تماسی را برای تولید سولفوریک اسید ثبت کرد که یک فرآیند بسیار اقتصادیتر برای تولیدتری اکسید گوگرد و “اسید سولفوریک غلیظ” بود. امروزه تقریباً تمام هیدروژن سولفات جهان با استفاده از این روش تولید میشود.
روشهای تولید اسید سولفوریک

تولید اسید سولفوریکاین ماده از طریق گوگرد، اکسیژن و آب از طریق فرآیند تماس عادی (DCDA) یا فرآیند مرطوب (WSA) تولید میشود.
۱-روش تولید H2SO4 از طریق فرآیند تماسی
در مرحله اول گوگرد میسوزد تا دی اکسید گوگرد تولید شود:
S+O2 → SO2
دی اکسید گوگرد توسط اکسیژن در حضور کاتالیزور اکسید وانادیوم (V) به تری اکسید گوگرد تبدیل میشود. این واکنش، برگشت پذیر است و تشکیل تری اکسید گوگرد، گرمازا است.2SO2 + O2
2SO2 + O2 ⇌2SO3
تری اکسید گوگرد به ۹۷-۹۸٪ H2SO4 جذب میشود تا ترکیب اولئوم (H2S2O7) تولید شود. همچنین به عنوان هیدروژن سولفات دود کننده نیز شناخته میشود. سپس اولئوم با آب، رقیق شده و هیدروژن سولفات غلیظ تشکیل میشود.
H2SO4+SO3 → H2S2O7
H2S2O7 + H2oO → 2H2SO4
۲-روش تولید اسید سولفوریک در فرآیند مرطوب
در مرحله اول، گوگرد میسوزد تا دی اکسید گوگرد تولید شود:
S+O2→SO2
یا، سولفید هیدروژن (H2S) گازی به SO2 گازی سوزانده میشود:
2H2S+3O2→ 2H2O+2SO2 (-518 kj/mol)
سپس دی اکسید گوگرد با استفاده از اکسیژن با اکسید وانادیوم (V) به عنوان کاتالیزور، به تری اکسید گوگرد اکسید میشود:
2SO2+O2 ⇌ 2SO3 (-99 kj/mol)
(واکنش برگشت پذیر است)
تری اکسید گوگرد به اسید سولفوریک هیدراته تبدیل میشود:
SO3+H2O → H2SO4 (g) (-101 kj/mol)
آخرین مرحله تراکم سولفوریک اسید به مایع ۹۷-۹۸٪ است:
H2SO4 (g) → H2SO4 (l) (-69 kj/mol)
۳- روشهای دیگر برای تولید هیدروژن سولفات:
این روشها به صورت آزمایشگاهی اجرا میشوند:
- واکنش اسید گوگرد، اسید نیتریک و آب:
3SO2 + 2HNO3 + 2H2O → 3H2SO4 + 2NO
- هیدروژن سولفات میتواند در آزمایشگاه با سوزاندن گوگرد در هوا و به دنبال آن حل شدن دی اکسید گوگرد حاصل در محلول پراکسید هیدروژن تولید شود:
SO2 + H2O2→ H2SO4
- روش دیگر، حل دی اکسید گوگرد در محلول آبی یک نمک فلزی اکسید کننده مانند کلرید مس (II) یا آهن (III) است:
2FeCl3 + 2H2O + SO2 → 2FeCl2 + H2SO4 + 2HCl
2CuCl2 + 2H2O + SO2 → 2CuCl + H2SO4 + 2HCl
خواص و کاربردهای اسید سولفوریک
۱-واکنش اسید سولفوریک با آب
از آنجا که واکنش هیدراتاسیون این اسید بسیار گرمازا است، رقیق کردن آن باید همیشه با افزودن اسید به آب و نه آب به اسید انجام شود. در این واکنش، یونهای هیدرونیوم تشکیل میشود:
–H2SO4+H2O → H3O+ + HSO4
–HSO4– + H2O → H3O+ + SO۴۲
همچنین از آنجا که هیدراتاسیون این اسید از نظر ترمودینامیکی، مطلوب است و میل آن برای ترکیب با آب به اندازه کافی قوی است، هیدروژن سولفات، یک ماده خشک کننده عالی محسوب میشود.
هیدروژن سولفات غلیظ اثر بسیار قوی دارد و باعث حذف آب از سایر ترکیبات شیمیایی از جمله قندها و سایر کربوهیدراتها میشود و در طی آن فرآیند، کربن، گرما و بخار تولید میشود.
۲-خواص اسید و باز
به عنوان یک اسید، این ماده با اکثر بازها واکنش میدهد و نمک سولفات را تولید میکند. به عنوان مثال، سولفات مس (II)، نمک مس، که معمولاً برای آبکاری استفاده میشود، از واکنش اکسید مس (II) با اسید سولفوریک تهیه میشود:
CuO (s) + H۲SO۴ (aq) → CuSO۴ (aq) + H۲O (I)
از هیدروژن سولفات نیز میتوان برای تبادل اسیدهای ضعیفتر از نمک آنها، استفاده کرد. به عنوان مثال، واکنش با استات سدیم، اسید استیک را مبادله میکند و سولفات سدیم را تشکیل میدهد:
N2SO4 + CH3COONa → NaHSO4 + CH3COOH
به همین ترتیب، میتوان از واکنش هیدروژن سولفات با نیترات پتاسیم برای تولید اسید نیتریک و رسوب بی سولفات پتاسیم استفاده کرد. هنگامی که اسید با اسید نیتریک ترکیب میشود، هم به عنوان یک اسید و هم به عنوان یک ماده کاهش دهنده آب عمل میکند و یون نیترونیوم را تشکیل میدهد.
۳-واکنش با فلزات
حتی هیدروژن سولفات رقیق با بسیاری از فلزات از طریق یک واکنش جابجایی- مانند سایر اسیدهای معمولی- واکنش نشان میدهد و گاز هیدروژن و نمک (سولفات فلز) تولید میکند. این فلزات واکنش پذیر (فلزات در موقعیتهای بالاتر از مس در سری واکنش شیمیایی) مانند آهن، آلومینیوم، روی ، منگنز، منیزیم و نیکل هستند.
واکنش آهن با اسید سولفوریک
Fe + H2SO4 → H2 + FeSO4
هیدروژن سولفات غلیظ به عنوان یک ماده اکسید کننده عمل میکند و دی اکسید گوگرد در واکنش، آزاد میشود:
+Cu + 2H۲SO۴ → SO۲ + 2H۲O + SO۴۲- + Cu۲
سرب و تنگستن در برابر سولفوریک اسید مقاوم هستند.
۴-واکنش اسید سولفوریک با کربن
هیدروژن سولفات غلیظ و داغ باعث اکسیداسیون کربن و گوگرد میشود.
C + 2H۲SO۴ → CO۲ + 2SO۲ + 2H۲O
S + 2H۲SO۴ → 3SO۲ + 2H۲O
۵-واکنش با کلرید سدیم
این ماده با کلرید سدیم واکنش میدهد و گاز کلرید هیدروژن و سولفات سدیم تولید میشود:
NaCl + H2SO4→ NaHSO4+ HCl
جدول مشخصات فیزیکی و شیمیایی جوهر گوگرد
| IUPAC نامگذاری سولفوریک اسید/Sulfuric acid |
|
| نامهای متداول دیگر: روغن ویترول/Oil of vitriol هیدروژن سولفات/Hydrogen sulfate |
|
| شاخصهای شناسایی | |
| ۷۶۶۴-۹۳-۹ | CAS Number |
| ۲۳۱-۶۳۹-۵ | EC Number |
| ۱۱۱۸ | PubChem CID |
| ۱۸۳۰ | UN number |
| ویژگیها و خواص | |
| H2SO4 | فرمول شیمیایی |
| مایع بی رنگ و شفاف | شکل ظاهری |
| بدون بو | بو |
| ۱۰.۳۱ °C | نقطه ذوب |
| ۳۳۷ °C/وقتی اسید در دمای بالاتر از ۳۰۰ درجه سانتیگراد حرارت داده میشود، معمولاً رهتری اکسید گوگر و آب تجزیه میشود. | نقطه جوش |
|
miscible, exothermic |
حلالیت در آب |
| ۰.۰۰۱ mmHg (20 °C) | فشار بخار |
| -۲.۸ , ۱.۹۹ | اسیدیته (pKa) |
| هیدروژن سولفات | باز مزدوج |
| ترکیبات مرتبط | |
| Selenic acid سلنیک اسید Hydrochloric acid هیدروکلریک اسید Nitric acid اسید نیتریک Chromic acid کرومیک اسید |
اسیدهای قوی – مرتبط با جوهر گوگرد |
| Sulfurous acid اسید سولفوروس Peroxymonosulfuric acid پر اکسی مونو سولفوریک اسید Sulfur trioxide تری اکسید سولفور Oleum اولئوم |
ترکیبات مرتبط |
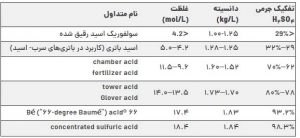
گریدهای اسید سولفوریک
اگرچه میتوان تقریباً ۱۰۰٪ محلول هیدروژن سولفات تولید کرد، اما پس از آن، در نقطه جوش، SO3 از بین میرود و غلظت اسید را به ۹۸.۳٪ میرساند.
گرید اسید ۹۸.۳٪ برای ذخیره سازی، پایدارتر است و فرم معمولتر، آن است که به عنوان “اسید سولفوریک غلیظ” توصیف میشود.
غلظتهای دیگر سولفوریک اسید صنعتی و خوراکی برای اهداف مختلف استفاده میشود. برخی غلظتهای معمول عبارتند از:
کاربردهای جوهر گوگرد
این ماده یک ماده شیمیایی صنعتی بسیار مهم است. بیشترین مقدار (حدود ۶۰٪) این اسید برای کودهای کشاورزی، به ویژه کود سوپرفسفاتها، فسفات آمونیوم و سولفاتهای آمونیوم مصرف میشود.
حدود ۲۰٪ از حجم اسید تولیدی در جهان در صنایع شیمیایی برای تولید مواد شوینده، رزینهای مصنوعی، مواد رنگی، داروسازی، کاتالیزورهای نفتی، حشره کش ها و ضد یخ مصرف میشود.
هیدروژن سولفات همچنین در فرآیندهای مختلف مانند اسیدی شدن چاههای نفتی، فرآیند کاهش آلومینیوم، اندازه بندی کاغذ، تصفیه آب و … استفاده میشود.
حدود ۶% موارد استفاده از این اسید مربوط به صنعت تولید رنگدانه ها است که شامل رنگ، لعاب، جوهر چاپ، رنگرزی نساجی است.
سایر کاربردهای صنعتی اسید سولفوریک مواردی از جمله تولید مواد منفجره، الیاف استات و ویسکوز، روان کنندهها، فلزات آهنی و باتریها هستند
۱-کاربرد هیدروژن سولفات صنعتی در تولید مواد شیمیایی

بیشترین کاربرد اسید سولفوریک در “روش مرطوب” برای تولید اسید فسفریک است که برای تولید کودهای فسفاته استفاده میشود. در این روش از سنگ فسفات استفاده میشود (سالانه بیش از ۱۰۰ میلیون تن فرآوری میشود).
این کار با سولفوریک اسید ۹۳٪ برای تولید سولفات کلسیم، هیدروژن فلوراید (HF) و اسید فسفریک تیمار میشود. HF به عنوان اسید هیدروفلوئوریک در واکنش، حذف میشود. واکنش کلی را میتوان به صورت زیر نشان داد:
Ca۵F(PO۴)۳ + 5H۲SO۴ + 10H۲O → 5CaSO۴.2H۲O + HF + 3H۳PO۴
سولفات آمونیوم، یک کود مهم ازته است و معمولاً به عنوان محصول جانبی از برنامههای کک سازی در کارخانههای تولید آهن و فولاد تولید میشود. واکنش آمونیاک تولید شده در تجزیه حرارتی ذغال سنگ با هیدروژن سولفات مازاد باعث میشود که آمونیاک به صورت نمک متبلور شود (که اغلب به دلیل آلودگی با آهن، قهوهای رنگ است) و به صنایع شیمیایی فروخته شود.
یکی دیگر از کاربردهای مهم این اسید صنعتی، تولید سولفات آلومینیوم است که به آن “آلوم تهیه کاغذ” نیز گفته میشود. این ترکیب با مقادیر کمی صابون روی الیاف کاغذ واکنش دهد و کربوکسیلات های آلومینیوم ژلاتینی حاصل میکند؛ در نتیجه، به انعقاد الیاف خمیر در سطح کاغذ منجر میشود.
این ترکیب همچنین برای ساخت هیدروکسید آلومینیوم استفاده میشود؛ هیدروکسید آلومینیوم در تصفیه خانههای آب برای تصفیه ناخالصیها و همچنین بهبود طعم آب استفاده میشود. سولفات آلومینیوم با واکنش بوکسیت با اسید سولفوریک ساخته میشود:
2AlO(OH) + 3H۲SO۴ → Al2(SO۴)۳ + 4H۲O
۲-کاربرد به عنوان عامل تمیز کننده در صنعت
این اسید در مقادیر زیاد در صنعت آهن و فولاد برای از بین بردن اکسیداسیون، زنگ زدگی و پوسته پوسته شدن از ورقها و پروفیلهای نورد شده قبل از فروش به صنعت خودروسازی استفاده میشود.
۳-کاربرد سولفوریک اسید در نقش کاتالیزور
از سولفوریک اسید برای اهداف دیگر در صنایع شیمیایی استفاده میشود. به عنوان مثال، این کاتالیزور اسیدی برای تبدیل سیکلوهگزانون اکسیم به کپرولاکتام، شناخته شده است که برای ساخت نایلون استفاده میشود.
به عنوان مثال دیگر، اسید سولفوریک، به عنوان یک کاتالیزور برای انجام واکنش ایزوبوتان با ایزوبوتیلن برای تولید ایزوکتان، ترکیبی که باعث افزایش درجه اکتان بنزین (بنزین) میشود.
۴- کاربرد هیدروژن سولفات در نقش الکترولیت
این ماده به عنوان الکترولیت در باتریهای اسید سرب (باتری اسید سرب) عمل میکند:
در آند:
–Pb + SO۴۲- ⇌ PbSO۴ + 2e
در کاتد:
PbO2 + 4H+ + SO۴۲- + 2e– ⇌ PbSO۴ + 2H۲O
به طور کلی:
Pb + PbO۲ + 4H+ + 2SO۴۲- ⇌ 2PbSO۴ + 2H۲O
۵-مصارف خانگی اسید سولفوریک
این ماده در غلظتهای بالا اغلب ماده اصلی پاک کنندههای اسیدی برای تخلیه لولهها و مسیرهای فاضلاب است. برای از بین بردن چربی، مو، دستمال کاغذی و غیره که در لولهها گیر کرده است از این اسید استفاده میشود.
ایمنی اسید سولفوریک
اسید سولفوریک خصوصاً وقتی که غلظت بالایی داشته باشد میتواند باعث سوختگیهای بسیار شدید شود؛ همانند سایر اسیدهای خورنده و ترکیبات قلیایی، این واکنش رخ میدهد.
اسید به راحتی و در اثر تماس با بافتهای زنده مانند پوست و گوشت، پروتئینها و لیپیدها را از طریق هیدرولیز آمید و استر تجزیه میکند. سولفوریک اسید با جذب قوی آب، گرمای اضافی را آزاد میکند و باعث سوختگی ثانویه میشود.
بر این اساس، در صورت پاشیده شدن به چشم میتواند باعث کوری دائمی شود. در صورت بلع، به ارگانهای داخلی آسیب می زند و برگشت ناپذیر است و حتی ممکن است کشنده باشد.
از این رو همیشه باید هنگام کار با این اسید، از تجهیزات حفاظتی استفاده شود. علاوه بر این، خاصیت اکسید کننده قوی آن باعث میشود که برای بسیاری از فلزات بسیار خورنده باشد. به همین دلایل، صدمه ناشی از اسید سولفوریک به طور بالقوه شدیدتر از سایر اسیدهای قوی مانند اسید کلریدریک و اسید نیتریک است.
این اسید باید با دقت در ظروف ساخته شده از مواد غیر واکنش دهنده (مانند شیشه) ذخیره شود. محلولهای قویتر از ۱.۵ مولار اسید باید دارای برچسب “CORROSIVE” یا همان “خورنده” باشند.
در حالی که محلولهای اسید با غلظتهای بیشتر از ۰.۵ مولار و کمتر از ۱.۵ مولار باید دارای برچسب “IRRITANT” یا تحریک کننده باشند.
کمکهای اولیه در صورت ریختن اسید روی پوست، مانند سایر عوامل خورنده، شستشو با مقدار زیادی آب است. شستشو حداقل به مدت ده تا پانزده دقیقه برای خنک شدن بافت اطراف سوختگی اسیدی و جلوگیری از آسیب ثانویه باید ادامه یابد.
H2SO4، غیر قابل اشتعال است. قرار گرفتن در معرض آئروسل منتشر شده از اسید سولفوریک در غلظتهای بالا منجر به تحریک فوری و شدید چشم، دستگاه تنفسی و غشاهای مخاطی میشود. حتی ممکن است احتمال سرطان ریه را تا ۶۴ درصد افزایش دهد.
خطرات رقیق کردن هیدروژن سولفات
تهیه هیدروژن سولفات رقیق به دلیل گرمای آزاد شده در فرآیند رقت میتواند خطرناک باشد. برای جلوگیری از پاشیدن اسید به بیرون از ظرف، اسید غلیظ معمولاً به آب اضافه میشود و نه برعکس.
ظرفیت گرمایی آب نسبت به اسید، بیشتر است و بنابراین ظرف آب سرد با افزودن اسید، گرما را جذب میکند.
همچنین چون اسید، چگال تر از آب است، به ته ظرف فرو میرود. گرما در ته ظرف آزاد میشود و به همین دلیل است با افزودن ناگهانی، ممکن است اسید به بیرون بپاشد.
آماده سازی محلولهایی با غلظت بیشتر از ۶ مولار (۳۵٪) خطرناکترین است، زیرا گرمای تولید شده ممکن است برای جوشش اسید رقیق شده کافی باشد؛ برای این کار استفاده از هم زدن مکانیکی و عامل خنک کننده خارجی (مانند حمام یخی) ضروری است.
نرخ واکنش پذیری هیدروژن سولفات نسبت به هر ۱۰ درجه سانتیگراد افزایش دما، دو برابر میشود. بنابراین با ادامه رقت، واکنش، شدیدتر خواهد شد؛ مگر اینکه به مخلوط، زمان کافی داده شود تا خنک شود. افزودن اسید به آب گرم باعث واکنش شدیدتر میشود. این را در مورد خطرات سولفوریک اسید به خاطر داشته باشید.
شرایط نگهداری هیدروژن سولفات
برای پایین نگه داشتن غلظت بخارات منتشر شده از هیدروژن سولفات، باید انبارهای نگهداری مخازن و بشکهها دارای تهویه قوی باشند. کارگرانی که با این اسید سروکار دارند باید تمام اقدامات ایمنی را رعایت کنند و پوشش کامل را داشته باشند.
عینک، دستکشهای لاستیکی چند لایه، ماسک چند لایه، لباسهای ضخیم و آستین بلند، همیشه و همیشه مهم هستند. در صورت امکان، پوشیدن چکمههای مخصوص محل کار هم توصیه میشود. کارگران باید به خوبی برای کار با این اسید و نحوه برخورد با حوادث ناشی از آن آموزش دیده باشند.
در صورت نگهداری در ظرفهای غیر واکنش پذیر، درب ظرف را محکم بسته نگه دارید. مخازن نگهداری سولفوریک اسید نباید به هیچ عنوان فلزی باشد؛ اسید با فلز واکنش داده وهیدروژن تخلیه میشود.
بسته بندی اسید سولفوریک
بسته بندیهای اسید سولفوریک مرک برای کاربردهای آزمایشگاهی معمولاً در حجم ۵/۲ لیتری در ظروف شیشهای، یا حجمهای ۱ لیتری، ۵ لیتری، ۱۰ لیتری و ۲۰ لیتری در ظروف پلی اتیلنی ارائه میشود.
بسته بندی سولفوریک اسید صنعتی و خوراکی برای مصرف در صنعت عموماً در بشکههای پلی اتیلنی با حجم ۲۲۰ لیتری میباشد. حمل و نقل به صورت فلهای هم امکان پذیر است. قیمت خرید اسید سولفوریک در هر بسته بندی، متفاوت است.
بازار و خرید و فروش اسید سولفوریک
تا به اینجا همه چیز درباره این اسید را به صورت خلاصه بررسی کردیم. خرید و فروش اسید سولفوریک، به عنوان یک ماده پر مصرف در صنعت، بازار پر تقاضایی دارد. قیمت سولفوریک اسید به صورت فلهای برای اهداف صادراتی معمولاً با قیمت خرید سولفوریک اسید به صورت حمل در بشکههای پلی اتیلنی بسیار متفاوت است. حمل فلهای برای قیمت اسید، به ازای هر لیتر، ارزانتر خواهد بود.
 تأمین کنندگان ایرانی اسید سولفوریک
تأمین کنندگان ایرانی اسید سولفوریک
منابع:
http://www.northeastern.edu/wanunu/WebsiteMSDSandSOPs/MSDS/Msds_Sulfuric_Acid.pdf
آخرین دیده شده ها














 (6 امتیاز)
(6 امتیاز)

دیدگاه کاربران
۲۰ کود ارگانیک خانگی برای گیاهان آپارتمانی
برنامه کوددهی درخت انگور: راهنمای جامع برای تاکستان داران
جدول برنامه کوددهی درخت گردو: راهنمای جامع ماهانه
جدول برنامه کوددهی درخت پسته: راهنمای جامع ماه به ماه
جدول کوددهی درختان میوه در تابستان: راز باغ های پربار
بهترین کود پتاسیم برای درخت زردآلو: راز میوههای طلایی و باغی پربار
کاشت هندوانه بدون مصرف آب؛ معجزه ای در دل کویرهای ایران
جدول زمان سمپاشی درختان میوه: راهنمای جامع برای باغبانی در سال ۱۴۰۴
کود تابستانه درختان: راهنمای جامع انتخاب بهترین کودها برای رشد بهینه
۵ روش علمی و سنتی برای گرفتن تلخی زیتون
گرما زدگی در گیاهان و درختان: راهنمای جامع پیشگیری و درمان تنش گرمایی
استخراج طلا از بردهای الکترونیکی: راهنمای جامع
گیلسونایت چیست؟ ویژگیها، خواص و کاربرد قیر معدنی
سولفات منیزیم چیست؟ خواص، روش تولید و کاربردهای منیزیم سولفات
همه چیز درباره هیدروکلریک اسید | دسترسی به قیمت روز اسید کلریدریک
همه چیز درباره بنتونیت (bentonite)
همهچیز درباره کود فسفاته دی آمونیوم فسفات| DAP
پرمنگنات پتاسیم | ویژگیها، روش تولید و کاربردهای آن
نمک صنعتی: روش تولید و کاربردهای کلرید سدیم
سود مایع چیست؟ همه چیز درباره سود سوزآور مایع
مونو اتیلن گلایکول| روش تولید، ویژگیها و کاربردهای MEG
همه چیز درباره متانول و ۹ کاربرد اصلی این ماده
سولفات آهن چیست؟ | همه چیز درباره سولفات آهن
نشادر چیست؟ | خواص، کاربردها و بازار خرید و فروش کلرید آمونیوم