سولفات سدیم چیست؟- سولفات سدیم را به طور کامل بشناسیم

فهرست مطالب
سولفات سدیم چیست ؟
خواص، ویژگیها، روش تولید و کاربردها
سولفات سدیم (Na2SO4) با نامهای سدیم سولفات، نمک گلوبر و سولفات سودا نیز شناخته میشود و یک نمک معدنی از اسید سولفوریک است.
این ترکیب از نظر ساختار مولکولی به صورت هیدراته و بدون آب تولید میشود. تمام فرمهای ساختاری سدیم سولفات، جامد سفید رنگ هستند و در آب حل میشوند.
فرم دکا هیدراته این نمک یا همان سولفات ده آبه، سالانه ۶ میلیون تن تولید میشود و یک محصول شیمیایی عمده است. این ماده عمدتاً برای ساخت مواد شوینده و فرآیند کرافت در تهیه خمیر کاغذ استفاده میشود.
انواع ساختار و فرم مولکولی برای سولفات سدیم
- سولفات سدیم بی آب؛ که به عنوان ماده معدنی “تناردیت” شناخته میشود؛ به عنوان ماده خشک کننده در سنتز ترکیبات آلی به کار میرود.
- هپتاهیدرات سدیم سولفات (۷ آبه)؛ یک شکل بسیار کمیاب.
- سدیم سولفات دکا هیدراته یا فرم ده آبه؛ معروف به ماده معدنی میرابیلیت، که به طور گسترده در صنایع شیمیایی استفاده میشود. همچنین به عنوان نمک گلوبر (Glauber’s salt) شناخته میشود.
درباره تاریخچه سولفات سدیم

سولفات سدیم پودریسولفات سدیم ده آبه (دکا هیدرات) پس از آنکه “یوهان رودولف گلاوبر” (۱۶۰۴–۱۶۷۰) آن را در سال ۱۶۲۵ در آب یک چشمه در اتریش کشف کرد، به عنوان “نمک گلابر” شناخته شد.
یوهان، این کشف را به دلیل خواص دارویی آن، sal mirabilis ( = نمک معجزه آسا) نام گذاشت. در دهه ۱۹۰۰، شناخت دقیقتری از این ترکیب معدنی به دست آمد.
در قرن هجدهم، نمک گلاوبر از طریق واکنش با ترکیب قلیایی کربنات پتاسیم، به عنوان ماده خام برای تولید صنعتی سودا اَش (= کربنات سدیم) استفاده شد.
تقاضا برای مصرف کربنات سدیم افزایش یافت و عرضه سدیم سولفات نیز باید افزایش پیدا میکرد. بنابراین در قرن نوزدهم، فرآیند مهم و معروف Leblanc، برای تولید سدیم سولفات سنتزی به عنوان حد واسط و سپس تبدیل آن به کربنات سدیم، انجام گرفت.
روش تولید سولفات سدیم
تولید جهانی سولفات سدیم، تقریباً به طور ویژه به شکل دکا هیدراته یا ده آبه است و تقریباً به ۵/۵ تا ۶ میلیون تن در سال میرسد.
در سال ۱۹۸۵، تولید این نمک، نیمی از منابع طبیعی و نیمی به روش شیمیایی انجام میشد.
پس از سال ۲۰۰۰، در یک سطح پایدار تولید تا سال ۲۰۰۶، تولید طبیعی سدیم سولفات به ۴ تن (= به ازای هر تن در سالهای قبل) افزایش یافت.
۱-منابع طبیعی سولفات سدیم
دو سوم حجم تولید فرم دکا هیدراته سولفات سدیم (نمک گلاوبر) در جهان از ماده معدنی طبیعی میرابیلیت است.
در سال ۱۹۹۰، مکزیک و اسپانیا تولید کنندگان عمده سدیم سولفات طبیعی در جهان (هر کدام حدود ۵۰۰۰۰۰ تن) بودند. روسیه، ایالات متحده و کانادا هر کدام حدود ۳۵۰۰۰۰ تن این نمک معدنی را تولید میکردند.
سدیم سولفات بی آب در محیطهای خشک به عنوان ماده معدنی “تاوناردیت” تشکیل میشود. این ماده معدنی به آرامی در هوای مرطوب به mirabilite تبدیل میشود.
سدیم سولفات همچنین به صورت گلاوبریت، یک ماده معدنی شامل ساختار سولفات سدیم- کلسیم یافت میشود. هر دو ماده معدنی، کمتر از میرابیلیت به مصرف میرسند.
۲-تولید صنعتی سولفات سدیم در صنایع شیمیایی
حدود یک سوم سولفات سدیم جهان به صورت محصول جانبی سایر فرآیندهای صنایع شیمیایی تولید میشود. حجم زیادی از این ترکیب از نظر شیمیایی به عنوان یک محصول جانبی تولید میشود اما در حال حاضر از نظر اقتصادی، بسیار کم است.
تلاش بر این است که در صنایع شیمیایی، تولید سدیم سولفات به عنوان محصول جانبی در حال کاهش باشد و بتوان آن را در جایگاه یک محصول اصلی تولید کرد.
مهمترین روش صنعتی برای تولید سدیم سولفات، تولید آن در حین فرایند تولید اسید کلریدریک است.
از ترکیب کلرید سدیم (نمک) و اسید سولفوریک در فرآیند مانهایم و یا از دی اکسید گوگرد در فرآیند هارگریوز (Hargreaves)، سدیم سولفات به دست میآید.
فرآیند مانهایم
2NaCl + H2SO4 →2HCl + NaSO4
فرآیند هارگریوز
NaCl + 2SO2 + O2 + 2H2O → 4HCl + 2NaSO4
دومین روش اصلی تولید سولفات سدیم، فرآیندهایی است که هیدروکسید سدیم اضافی توسط اسید سولفوریک خنثی میشود. این روش در واقع یک روش آزمایشگاهی برای تولید سدیم سولفات است که بسیار گرمازا است:
2NaOH (aq) + H2SO4 (aq) → Na2SO4 (aq) +2 H2O (l) ΔH = -112.5 kJ
در آزمایشگاه همچنین میتوان از واکنش بین بی کربنات سدیم و سولفات منیزیم، سدیم سولفات را سنتز کرد.
2NaHCO3 + MgSO4 → Na2SO4 + Mg (OH) 2 + 2CO2
با این حال چون منابع تجاری به راحتی برای تولید سولفات سدیم در دسترس هستند، سنتز آزمایشگاهی غالباً انجام نمیشود.
در گذشته، سدیم سولفات یکی از محصولات جانبی تولید دی کرومات سدیم بود؛ در این روش اسید سولفوریک به محلول کرومات سدیم اضافه میشود و دی کرومات سدیم و اسید کرومیک تشکیل میشود.
سدیم سولفات فلهای معمولاً به صورت فرم ساختاری دکا هیدراته خالص سازی میشود، زیرا شکل بیآب آن تمایل به جذب ترکیبات آهن و ترکیبات آلی دارد. فرم سدیم سولفات بدون آب به راحتی و در اثر گرما از فرم هیدراته به این ساختار تبدیل میشود.
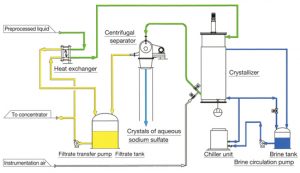
فرایند کریستالیزه کردن سولفات سدیم
خواص سولفات سدیم
خواص شیمیایی:
سدیم سولفات یک سولفات یونی با پیوندهای الکترواستاتیک است. وجود یونهای آزاد سولفات در محلول منجر به تشکیل آسان سولفاتهای نامحلول میشود. که این محلولها با نمکهای باریم و سرب، تیمار میشوند:
Na2SO4 + BaCl2 →۲ NaCl + BaSO4
سدیم سولفات نسبت به اکثر عوامل اکسید کننده یا کاهنده، غیر فعال است. در دماهای بالا میتوان آن را با کاهش کربوترمال (= حرارت دادن با دمای بالا در حضور زغال و …) به سولفید سدیم تبدیل کرد:
Na2SO4 +2 C → Na2S +2 CO2
این واکنش در فرآیند Leblanc، یک مسیر برای تولید کربنات سدیم استفاده میشد.
سدیم سولفات با اسید سولفوریک واکنش میدهد و نمک بی سولفات سدیم را تشکیل میدهد:
Na2SO4 + H2SO4 ⇌ ۲ NaHSO4
سولفات سدیم تمایلی به تشکیل نمکهای دو جزئی نشان میدهد. تنها آلوم های تهیه شده با فلزات سه ظرفیتی رایج، NaAl(SO4)2 (=ناپایدار در بالای ۳۹ درجه سانتیگراد) و NaCr(SO)2 هستند؛ در مقابل، سولفات پتاسیم و سولفات آمونیوم بسیاری از زاجهای پایدار را تشکیل میدهند.
نمکهای مضاعف به فرم برخی سولفاتهای فلز قلیایی نیز شناخته شده است؛ از جمله Na2SO4.3K2SO4 که به طور طبیعی به عنوان ماده معدنی “آفتیتالیت” تشکیل میشود.
خواص و ویژگیهای فیزیکی
سدیم سولفات دارای خصوصیات غیرمعمول برای حلالیت در آب است.
حلالیت آن در آب، بین ۰ درجه سانتیگراد تا ۳۲.۳۸۴ درجه سانتیگراد بیش از ده برابر افزایش مییابد، در این شرایط، حلالیت حداکثر به ۴۹.۷ گرم در ۱۰۰ میلی لیتر میرسد.
در این مرحله منحنی حلالیت شیب تغییر میکند و حلالیت تقریباً از دما مستقل میشود. دمای ۳۸/۳۲۴ درجه سانتیگراد مربوط به آزاد شدن کریستال در آب و ذوب نمک هیدراته است.
ویژگیها و مشخصات فیزیکی و شیمیایی سولفات سدیم
| نام ترکیب شیمیایی | |
| Sodium sulphate سدیم سولفات Sulfate of sodium سولفات سدیم Thenardite (mineral) تناردیت – معدنی Glauber’s salt (decahydrate) نمک گلاوبرز – ده آبه Sal mirabilis (decahydrate) میرابیلیت – ده آبه Mirabilite (decahydrate mineral)میرابیلیت ده آبه – معدنی Disodium sulfate دی سدیم سولفات |
|
| شاخصهای شناسایی | |
| ۷۷۵۷-۸۲-۶ 7727-۷۳-۳ (فرم ده آبه) |
CAS Number |
| E514 | E Number |
| ۲۴۴۳۶ | PubChem CID |
| ویژگیها | |
| Na۲SO۴ | فرمول شیمیایی |
| ۱۴۲.۰۴ g/mol (بدون آبه) 322.۲۰ g/mol (ده آبه) |
جرم مولی |
| کریستالهای جامد سفید رنگ | شکل ظاهری |
| بدون بو | بو |
| ۲.۶۶۴ g/cm۳ (بدون آب) 1.۴۶۴ g/cm۳ (فرم ده آبه) |
دانسیته |
| ۸۸۴ °C (1,623 °F; 1,157 K) (بدون آب) 32.۳۸ °C (فرم ده آبه) |
نقطه ذوب |
| ۱,۴۲۹ °C (2,604 °F; 1,702 K) (بدون آب) | نقطه جوش |
| فرم بدون آب: 4.۷۶ g/100 mL (0 °C) 28.۱ g/100 mL (25 °C)[۱] 42.۷ g/100 mL (100 °C) فرم هپتا هیدراته: 19.۵ g/100 mL (0 °C) 44 g/100 mL (20 °C) |
حلالیت در آب |
| نامحلول در اتانول محلول در گلیسرول – آب – هیدروژن یدید |
حلالیت در سایر حلالها |
| ویژگیهای ساختاری | |
| اورتو ترومبیک (فرم بدون آب) مونو کلینیک(فرم ده آبه) |
ساختار کریستالی |
| ترکیبات مرتبط با سدیم سولفات | |
| سدیم سلنات سدیم تلورات |
آنیونها |
| لیتیم سولفات سولفات پتاسیم سولفات روبیدیم سولفات سزیم |
کاتیونها |
| سدیم بی سولفات سدیم سولفیت سدیم پر سولفات |
ترکیبات مربوطه |
کاربردهای سولفات سدیم
۱-سولفات سدیم کاربرد صنعتی
- به عنوان ماده پر کننده در مواد شوینده خانگی و پودر لباس شویی (سولفات سدیم مادهای بسیار ارزان است. ۵۰ ٪ تولید جهانی از این نمک به این کاربرد اختصاص دارد اما این مصرف در حال کاهش است؛ زیرا مصرف کنندگان به طور فزاینده به خرید مواد شوینده بهتر یا شویندههای مایع روی میآورند که شامل سدیم سولفات نیستند.)
- یکی دیگر از موارد عمده استفاده از سولفات سدیم، مصرف در فرآیند کرافت برای تولید خمیر چوب است. (به دلیل ارتقای بهره وری حرارتی در فرآیند بازیابی کرافت در اوایل دهه ۱۹۶۰، بازیابی گوگرد، بسیار کارآمدتر شد و نیاز به ترکیب سولفات سدیم به شدت کاهش یافت.)
- صنعت شیشه یکی دیگر از کاربردهای مهم سدیم سولفات در جهان و به عنوان دومین کاربرد بزرگ در اروپا میباشد. (سولفات سدیم به عنوان یک ماده حذف کننده برای کمک به از بین بردن حبابهای کوچک هوا در شیشه مذاب استفاده میشود.)
- سدیم سولفات در تولید منسوجات بیشترین کاربرد را دارد مهم است. سدیم سولفات، بارهای منفی الیاف را کاهش میدهد تا رنگها بتوانند به طور یکنواخت در آنها نفوذ کنند. بر خلاف کلرید سدیم، نمک سولفات باعث خوردگی ظروف استیل ضد زنگ که در رنگرزی به کار میروند، نمیشود.
۲-کاربردهای سولفات سدیم در صنایع غذایی:
سولفات سدیم به عنوان رقیق کننده برای رنگهای خوراکی در صنایع غذایی استفاده میشود. این ترکیب به عنوان افزودنی مناسب شناخته میشود.
۳-کاربرد سولفات سدیم در شویندهها:
سدیم سولفات در تولید شامپو چه نقشی دارد؟

کاربرد سولفات سدیم در تولید شوینده هاسولفاتها مهمترین مواد شیمیایی هستند که به عنوان مواد اولیه صنعتی در تولید پاک کنندهها و شویندهها استفاده میشوند. نمکهای سولفات مانند سدیم سولفات هیدروژن و سدیم سولفات لوریل را میتوان در پاک کنندههای خانگی، شویندهها و حتی شامپوها یافت.
در شامپوها از دو نوع اصلی سولفات استفاده میشود: سدیم لوریل سولفات و سدیم لور اتر سولفات (سدیم لوریل اتر سولفات).
هدف از مصرف این سولفاتها ایجاد اثر کف کنندگی برای از بین بردن چربیها و آلودگی موهای سر است. اگر شامپوی شما به راحتی کف میکند، به احتمال زیاد حاوی سولفات سدیم است.
در مقایسه با سایر مواد پاک کننده موجود در شامپو، سولفاتها عمیقترین اثرات پاک کنندگی را دارند. این ترکیبات به یک دسته از پاک کنندهها به نام “سورفکتانت آنیونی” تعلق دارند.
استفاده از سولفات در شامپو در دهههای اخیر بحث برانگیز بوده است. برخی معتقدند که سولفاتها میتوانند به طور مستقیم به سلامتی فرد آسیب برسانند.
از آنجا که در بسیاری از موارد از شامپو به صورت روزانه استفاده میشود، تصور بر این است که تماس زیاد با سولفاتها میتواند خطرات جدی را به دنبال داشته باشد.
شامپوهای حاوی سولفات ممکن است به انواع خاصی از مو آسیب برساند و حتی ممکن است در برخی افراد باعث تحریک پوست شود.
۴-سایر کاربردهای سولفات سدیم:
به طور گسترده در صنایع شویندههای مصنوعی، نایلون، رنگ و رنگرزی، شیشه گری، داروسازی، چرم و لاستیک استفاده میشود.
بسته بندی سولفات سدیم
برای سولفات سدیم خوراکی و سدیم سولفات صنعتی، بسته بندیهای ۲۵ کیلوگرمی، ۵۰ کیلوگرم و جامبوبگ ۱۰۰۰ کیلوگرمی ارائه میشود. بنابر سفارش مشتری، این بسته بندیها در پالتها قابل حمل هستند.
ایمنی سولفات سدیم | MSDS
اگرچه سدیم سولفات خوراکی و صنعتی به طور کلی غیر سمی است اما باید با احتیاط با آن کار کرد. گرد و غبار ناشی از این ترکیب جامد میتواند باعث آسم موقتی یا تحریک چشمها شود.
بهتر است افرادی که با این ترکیب سر و کار دارند، با استفاده از محافظ چشم و ماسک از این آسیبها جلوگیری کنند. حمل و نقل بستههای این ترکیب، محدود نیست و هیچ عبارت خطر یا عبارت ایمنی بر روی بستهها درج نمیشود.
بعد از کار کردن با این ترکیب سولفاته باید دستهای خود را کاملاً با آب بشویید. برای حذف آلودگی، لباسها را قبل از استفاده مجدد شستشو دهید.
این ترکیب میتواند رطوبت هوا را جذب کند و در حالت نمناک بودن، پوست را تحریک میکند. ممکن است در برخی افراد واکنش آلرژیک ایجاد کند.
در صورت بلع تصادفی سدیم سولفات، ممکن است با نشانههای تهوع و اسهال باعث تحریک دستگاه گوارش شود.
نگهداری سولفات سدیم
انبارهای محل نگهداری این بستهها باید تهویه مناسب داشته باشد. هر گونه امکان تولید و تجمع گرد و غبار ناشی از این ترکیب را به حداقل برسانید. حتماً از تماس سولفات با پوست، چشم و لباس اجتناب شود.
محل نگهداری بسته بندیهای سدیم سولفات باید خشک و خنک باشد. بستهها را از رطوبت محافظت کنید.
این تکیب در دمای اتاق در ظروف سر بسته در شرایط نگهداری استاندارد، پایدار است. این نمک معدنی، رطوبت یا آب را از هوا جذب میکند.
سدیم سولفات در تماس با عوامل اکسید کننده قوی، اسیدهای قوی، آلومینیوم، منیزیم ناسازگاری دارد.
اگر این ترکیب به هر دلیلی تجزیه شود، محصولات خطرناک شامل اکسیدهای گوگرد و اکسید سدیم را تولید میکند.
بازار خرید و فروش سولفات سدیم
خرید و فروش نمک سولفات سدیم اراک (شرکت املاح معدنی ایران)، سولفاتیک، پارسیان پارت پاسارگاد، درفش کاویان، فجر پارسیان و سولفات سدیم وارداتی در بسته بندیهای استاندارد و با خلوص ۹۸ درصد انجام میشود. سدیم سولفات با ساختار ۱۰ آبه و ۷ آبه و همچنین سدیم سولفات تناردیت در بازار موجود هستند.
تهیه پودر لباسشویی، انواع شامپوها و تهیه خوراک دام، مستلزم خرید حجم انبوهی از این نمک معدنی میباشند.
تولیدکنندگان سولفات سدیم در ایران، این محصولات را با قیمت مناسب و کیفیت عالی برای صنایع زیر دستی ارائه میدهند. سدیم سولفات خوراکی و صنعتی قابل سفارش به صورت اینترنتی میباشند. این نمک معدنی را میتوانید از وبسایت “شیمیکو” از تولید کننده سولفات سدیم به صورت مستقیم خریداری کنید.
 انتشار آگهی خرید و فروش سولفات سدیم
انتشار آگهی خرید و فروش سولفات سدیم
منابع:
https://fscimage.fishersci.com/msds/۲۱۶۳۰.htm
https://www.healthline.com/health/sulfate-in-shampoo
http://unitedfertilizer.com/wp-content/uploads/۲۰۱۶/۰۸/Sodium-Sulfate-Anhydrous-Fertilizer-Grade.pdf
آخرین دیده شده ها
















دیدگاه کاربران
جدول زمان بندی سمپاشی مرکبات برای باغداران ایرانی
چگونه آفات درختان میوه را کنترل کنیم؟
۲۰ کود ارگانیک خانگی برای گیاهان آپارتمانی
برنامه کوددهی درخت انگور: راهنمای جامع برای تاکستان داران
جدول برنامه کوددهی درخت گردو: راهنمای جامع ماهانه
جدول برنامه کوددهی درخت پسته: راهنمای جامع ماه به ماه
جدول کوددهی درختان میوه در تابستان: راز باغ های پربار
بهترین کود پتاسیم برای درخت زردآلو: راز میوههای طلایی و باغی پربار
کاشت هندوانه بدون مصرف آب؛ معجزه ای در دل کویرهای ایران
جدول زمان سمپاشی درختان میوه: راهنمای جامع برای باغبانی در سال ۱۴۰۴
کود تابستانه درختان: راهنمای جامع انتخاب بهترین کودها برای رشد بهینه
۵ روش علمی و سنتی برای گرفتن تلخی زیتون
گیلسونایت چیست؟ ویژگیها، خواص و کاربرد قیر معدنی
سولفات منیزیم چیست؟ خواص، روش تولید و کاربردهای منیزیم سولفات
همه چیز درباره هیدروکلریک اسید | دسترسی به قیمت روز اسید کلریدریک
همه چیز درباره بنتونیت (bentonite)
همهچیز درباره کود فسفاته دی آمونیوم فسفات| DAP
پرمنگنات پتاسیم | ویژگیها، روش تولید و کاربردهای آن
نمک صنعتی: روش تولید و کاربردهای کلرید سدیم
سود مایع چیست؟ همه چیز درباره سود سوزآور مایع
مونو اتیلن گلایکول| روش تولید، ویژگیها و کاربردهای MEG
همه چیز درباره متانول و ۹ کاربرد اصلی این ماده
سولفات آهن چیست؟ | همه چیز درباره سولفات آهن
نشادر چیست؟ | خواص، کاربردها و بازار خرید و فروش کلرید آمونیوم