اسید نیتریک چیست؟ | همه چیز درباره اسیدنیتریک

فهرست مطالب
اسید نیتریک چیست؟ روشهای تولید، ویژگیها و کاربردها
اسید نیتریک به فرمول شیمیایی HNO3، یک اسید معدنی بسیار خورنده است. این اسید به صورت خالص و بیرنگ است. نیتریک اسید در بازار با خلوص ۶۵% یا ۶۸% وجود دارد که معمولاً به صورت محلول در آب است.
اگر غلظت این اسید به بیشتر از ۸۶% برسد، از آن به عنوان اسید بخار استفاده میشود. بسته به مقدار دی اکسید نیتروژن موجود، بخار این اسید تقریباً رنگ قرمز رنگ پیدا میکند و اگر غلظت آن به بیشتر از ۹۵% برسد، این بخارات به رنگ سفید تغییر رنگ میدهند. این تغییرات یعنی اسید، بسیار خورنده و خطرناک میشود!
اسید نیتریک یک واکنشگر اصلی است که برای نیتراسیون استفاده میشود. واکنش نیتراسیون یعنی افزودن یک گروه نیترو به طور معمول به یک مولکول آلی.
در حالی که برخی از ترکیبات حاصل از نیتروژن، مواد منفجره یا حساس به شوک الکتریکی و حرارت هستند، تعدادی از آنها نسبتاً پایدار هستند که میتوانند در مواد منفجره و برای تخریب استفاده شوند، برخی دیگر نیز بسیار پایدارتر هستند و به عنوان رنگدانه در جوهرها و رنگها به کار میروند. از نیترات هیدروژن معمولاً به عنوان یک ماده اکسیدکننده قوی استفاده میشود.
نگاهی به تاریخچه اسید نیتریک
اولین بار، نام اسید نیتریک در یافتهها و اکتشافات شیمیدان ایرانی، محمد بن زکریای رازی (۸۵۴–۹۲۵) آورده شد.
آلبرت کبیر و “رامون لول” در قرن سیزدهم، دانشمندانی بودند که در مورد نیتریک اسید، تحقیقات خود را ادامه دادند. آنها از حرارت دادن niter و خاک رس، این اسید را تهیه کردند و آن را eau” forte” نامیدند.
در قرن هفدهم، “یوهان رودولف گلاوبر” روشی را برای تولید اسید نیتریک از طریق تقطیر نیترات پتاسیم با اسید سولفوریک ابداع کرد. در سال ۱۷۷۶، “آنتوان لاووازیه” با استناد به آثار “جوزف پریستلی” خاطرنشان کرد که میتواند از اکسید نیتریک، ترکیب شده با حجم تقریباً مساوی از هوا و آب به دست آید.
در سال ۱۷۸۵، “هنری کاوِندیش” ترکیب دقیق آن را تعیین کرد و نشان داد که با عبور جریان الکتریکی از هوای مرطوب میتوان اسید نیتریک را سنتز کرد.
در سال ۱۸۰۶، “همفری دیوی” با آزمایشهای گسترده الکترولیز آب مقطر، به این نتیجه رسید که نیتریک اسید در آند از گاز نیتروژن جوّ محلول تولید شده است.
او از یک باتری ولتاژ بالا و الکترودهای غیر واکنش دهنده و مخازنی شامل الکترود طلا استفاده کرد که مخازن با یک پل رابط ساخته شده از آزبست به هم متصل بودند.
تولید صنعتی اسید نیتریک
تولید صنعتی اسید نیتریک از هوای جوّ در سال ۱۹۰۵ با فرآیند Birkeland – Eyde آغاز شد که به آن فرآیند قوس نیز گفته میشود.
این فرآیند بر اساس اکسیداسیون نیتروژن جوّ توسط اکسیژن اتمسفر و تبدیل آن به اکسید نیتریک با قوس الکتریکی در دمای بسیار بالا است.
بازده این فرآیند، حداکثر حدود ۵/۵% اکسید نیتریک در دمای ۳۰۰۰ درجه سانتیگراد است و در دماهای پایینتر، بازدهی کمتری حاصل شد.
اکسید نیتریک توسط اکسیژن اتمسفر به دی اکسید نیتروژن، اکسید میشود. برای تولید نیتریک اسید رقیق، جذب آب در یک سری ستونها در برج سر بسته یا صفحات جذب کننده، انجام میگیرد.
روش دیگری برای تولید اسید نیتریک، توسط مهندس فرانسوی، “آلبرت نودون” در سال ۱۹۱۳ ابداع شد.
او توانست نیتریک اسید را از الکترولیز نیترات کلسیم را که توسط باکتریها از مواد نیتروژن دار در ذغال سنگ حاصل شده بود، تولید کند.
هنگامی که “فرآیند هابر” برای تولید آمونیاک در سال ۱۹۱۳ معرفی شد، تولید اسید نیتریک از آمونیاک با استفاده از “فرآیند استوالد” از تولید Birkeland – Eyde پیشی گرفت. این روش تولید، امروزه نیز مورد استفاده قرار میگیرد.
روشهای تولید اسید نیتریک
۱- تولید صنعتی نیتریک اسید
اسید نیتریک در اثر واکنش دی اکسید نیتروژن (NO2) با آب ساخته میشود.
۴ NO2 +2 H2O →۲ HNO3 + NO + NO2+ H2O
۳ NO2 + H2O →۲ HNO3 + NO
به طور معمول، اکسید نیتریک تولید شده در واکنش، توسط اکسیژن موجود در هوا، اکسید شده و دی اکسید نیتروژن اضافی تولید میکند. جوشاندن دی اکسید نیتروژن از طریق پراکسید هیدروژن میتواند به بهبود عملکرد اسید کمک کند.
۲ NO2 + H2O2 →۲ HNO3
محلولهای تجاری اسید نیتریک معمولاً دارای خلوط بین ۵۲٪ و ۶۸٪ اسید هستند. تولید نیتریک اسید از طریق فرآیند استوالد انجام میشود که به نام “ویلهلم استوالد”، شیمی دان آلمانی نامگذاری شده است.
در این فرآیند، آمونیاک بدون آب در حضور کاتالیزور پلاتین یا رودیم در دمای بالا حدود ۵۰۰ کلوین و فشار ۹ اتمسفر، به اکسید نیتریک، اکسید میشود:
(۴ NH3 (g) + 5 O2 (g) → ۴ NO (g) +6 H2O (g) (ΔH = -905.2 kJ / mol
سپس نیتریک اکسید با اکسیژن موجود در هوا واکنش داده و دی اکسید نیتروژن ایجاد میکند:
(۲ NO (g) + O2 (g) → ۲ NO2 (g) (ΔH = -114 kJ / mol
این فرآیند به طور پیوسته در آب، جذب میشود تا اسید نیتریک و اکسید نیتریک تشکیل شود:
(۳ NO2 (g) + H2O (l) →۲ HNO3 (aq) + NO (g) (ΔH = -117 kJ / mol
اکسید نیتریک برای اکسیداسیون مجدد وارد چرخه میشود. اگر آخرین مرحله در هوا انجام شود به صورت زیر است:
(۴ NO2 (g) + O2 (g) +2 H2O (l) →۴ HNO3 (aq
اسید نیتریک تولید شده در این واکنشها دارای خلوص ۶۸% است. خلوص بیشتر تا ۹۸٪ را میتوان با حذف آب و در حضور با سولفوریک اسید غلیظ به دست آورد.
با استفاده از آمونیاک حاصل از فرآیند هابر، محصول نهایی را میتوان از نیتروژن، هیدروژن و اکسیژن تولید کرد.
۲- تولید آزمایشگاهی نیتریک اسید
در آزمایشگاه، اسید نیتریک از تجزیه حرارتی نیترات مس (II)، تولید دی اکسید نیتروژن و گازهای اکسیژن و سپس با عبور از آب تولید میشود:
۲ Cu (NO3)2 →۲ CuO +4 NO2 + O2
سپس، فرآیند استوالد را دنبال کنید:
2NO2+H2O → HNO2+HNO3
روش دیگر تولید اسید نیتریک، واکنش مقدار برابر نمک نیترات مانند نیترات سدیم با اسید سولفوریک و تقطیر این مخلوط در نقطه جوش اسید نیتریک، ۸۳ درجه سانتی گراد، است. باقیمانده غیر فرار شامل سولفات هیدروژن فلزی در ظرف تقطیر باقی میماند. بخار نیتریک اسید از رنگ قرمز ممکن است به بخار سفید نیتریک اسید تبدیل شود:
NaNO3 + H2SO4 → HNO3 + NaHSO4
خواص نیتریک اسید

کاربرد اسید نیتریک در صنایع اسید نیتریک موجود در بازار یک آزوتروپ همراه با آب در غلظت ۶۸٪ اسید است. دمای جوش این محلول، ۱۲۰.۵ درجه سانتی گراد در ۱ اتمسفر است. این درصد خلوص به عنوان ” اسید نیتریک غلیظ” شناخته میشود.
به عنوان ویژگیهای ساختاری، نیتریک اسید با دو ساختار مونو هیدراته و تری هیدراته وجود دارد.
– آلودگی با دی اکسید نیتروژن
نیتریک اسید میتواند در اثر حرارت و گرما، تجزیه شود؛ به همین دلیل اغلب در بطریهای شیشهای قهوهای ذخیره میشود:
۴ HNO3 →۲ H2O +4 NO2 + O2
دی اکسید نیتروژن در نیتریک اسید محلول، باقی مانده و در دماهای بالاتر، آن را زرد یا حتی قرمز رنگ میکند. در حالی که اسید خالص تمایل دارد که در معرض هوا، بخارهای سفید ایجاد کند.
اسید با دی اکسید نیتروژن محلول، بخارهای قهوهای مایل به قرمز ایجاد میکند. اکسیدهای نیتروژن (NOx) در نیتریک اسید، محلول هستند.
گرید تجاری اسید نیتریک بخار حاوی ۹۸٪ اسید خالص و چگالی ۱.۵۰ گرم در سانتی متر مکعب است. این گرید اغلب در صنایع منفجره استفاده میشود. به اندازه نیتریک اسید بی آب، فرار و خورنده نیست و غلظت تقریبی آن ۲۱.۴ مولار است.
– اسید نیتریک بدون آب
نیتریک اسید بی آب به عنوان اسید ۹/۹۹ درصد در دسترس است. یکی از مشخصات اسید با بخار سفید این است که حداکثر ۲٪ آب و حداکثر ۰.۵٪ NO2 محلول دارد. این اسید دارای چگالی ۱.۵۱۳ گرم در سانتی متر مکعب است و غلظت تقریبی آن ۲۴ مولار است.
در دمای ۴۲- درجه سانتیگراد جامد میشود و بلورهای سفید تشکیل میدهد. در دمای ۸۳ درجه سانتی گراد میجوشد. این ماده معمولاً در یک بطری شیشهای کهربای ضد شکن و با دو برابر فضای سر نگهداری میشود تا احتمال ایجاد فشار در نظر گرفته شود.
– خواص اسید و باز
به طور معمول، اسید نیتریک در دمای محیط به عنوان یک اسید قوی در نظر گرفته میشود. اسید نیتریک میتواند به عنوان یک ماده واکنشگر با یک اسید دیگر مانند اسید سولفوریک واکنش دهد.
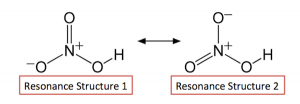
نیتریک اسید دارای هر دو خاصیت اسیدی و قلیایی است و میتواند تحت واکنش خود پروتون کافتی قرار گیرد:
۲ HNO3 ⇌ NO ۲+ + NO۳– + H2O
– واکنش با فلزات
اسید نیتریک با اکثر فلزات واکنش میدهد اما جزئیات آن به غلظت اسید و ماهیت فلز بستگی دارد. اسید رقیق در واکنش با اکثر فلزات مانند یک اسید معمولی رفتار میکند. واکنش با منیزیم، منگنز و روی باعث آزاد شدن هیدروژن میشود.
نیتریک اسید میتواند فلزات غیر فعال مانند مس و نقره را اکسید کند. در اثر واکنش با اسید نیتریک، بیشتر فلزات نیترات مربوطه را میدهند. برخی از فلزات نیز ترکیبات اکسید را تشکیل میدهند.
بعضی از فلزات گرانبها مانند طلای خالص و فلزات گروه پلاتین با نیتریک اسید واکنش نمیدهند. برخی از فلزات نجیب کمتر (Ag ، Cu ، …) موجود در برخی از آلیاژهای طلا که از نظر خلوص طلا نسبتاً ضعیف هستند، مانند طلای رنگی، میتوانند به راحتی اکسید شده و در اسید حل شوند و منجر به تغییر رنگ سطح آلیاژ طلا گردند.
اسید نیتریک به عنوان یک ماده اکسید کننده قوی با بسیاری از ترکیبات غیر فلزی به شدت واکنش نشان میدهد و ممکن است واکنشها انفجاری باشد.
بسته به غلظت اسید، دما و عامل احیا کننده، محصولات نهایی میتوانند متغیر هستند.
اگرچه کروم (Cr)، آهن (Fe) و آلومینیوم (Al) به راحتی در نیتریک اسید رقیق حل میشوند، اسید غلیظ یک لایه اکسید فلز تشکیل میدهد که قسمت عمده فلز را از اکسیداسیون بیشتر محافظت میکند.
– واکنش با غیر فلزات
اسید نیتریک به عنوان یک اسید اکسید کننده قوی با بسیاری از مواد آلی به شدت واکنش نشان میدهد.
در گروه هیدروکسیل، معمولاً یک هیدروژن از مولکول آلی جدا میشود تا آب تشکیل شود و گروه نیترو باقی مانده جای هیدروژن را میگیرد.
نیترات دهی ترکیبات آلی با نیتریک اسید، روش اصلی سنتز بسیاری از مواد منفجره معمول مانند نیتروگلیسیرین و ترینیتروتولوئن (TNT) است.
کاربردهای اسید نیتریک
اصلیترین کاربرد صنعتی نیترات هیدروژن برای تولید انواع کودهای کشاورزی است. اسید نیتریک با آمونیاک، خنثی میشود و نیترات آمونیوم را حاصل میکند.
سایر کاربردهای اصلی این اسید برای تولید مواد منفجره، پیش سازهای نایلون و ترکیبات آلی ویژه است.
کاربرد صنعتی اسید نیتریک:
- پیش ماده برای سنتز ترکیبات آلی نیتروژن دار
- به عنوان ترکیب اکسید کننده در فرآیندهای صنعتی
- پیش ماده تهیه نایلون
- ماده اولیه برای سنتز آدیپیک اسید
ایمنی و MSDS اسید نیتریک
اسید نیتریک یک اسید خورنده و یک ماده اکسیدکننده قوی است. عمده خطرات آن شامل سوختگیهای شیمیایی است؛ زیرا اسید با پروتئینها (آمید) و چربیها (استر) روی پوست، واکنش هیدرولیز انجام میدهد، در نتیجه، بافت زنده تجزیه میشود.
نیتریک اسید غلیظ به دلیل واکنش با کراتین، پوست انسان را زرد رنگ میکند. این لکههای زرد در هنگام خنثی شدن، به نارنجی تغییر رنگ میدهند.
به همین دلیل است که به شدت توصیه میشود افرادی که با گرید صنعتی و گرید آزمایشگاهی اسید نیتریک کار میکنند همیشه دستکش، ماسک و عینک استفاده کنند. پوشیدن لباس آستین بلند هم الزامی است.
کمکهای اولیه هنگام ریختن اسید بر روی پوست، همانند سایر عوامل خورنده، شامل شستشوی زیاد با آب است. شستشو به مدت حداقل ۱۰-۱۵ دقیقه برای خنک شدن محل سوختگی اسیدی و جلوگیری از آسیبهای ثانویه باید ادامه یابد.

بستهبندی اسید نیتریک
بسته بندی نیترات هیدروژن و حمل آن به صورت حمل با تانکرها، گالنهای ۵ لیتری و ۲۰ لیتری، بشکههای ۲۲۰ لیتری انجام میشود.
گرید آزمایشگاهی این اسید در بطریهای تیره رنگ با حجم ۵/۲ لیتر به فروش میرسد. اسید نیتریک مرک، یکی از معروفترین برندهای این ماده شیمیایی در جهان است.
شرایط نگهداری اسید نیتریک
نیترات هیدروژن به عنوان یک ماده اکسید کننده قوی میتواند با ترکیباتی مانند سیانیدها، کاربیدها یا پودرهای فلزی به طور خطرناک ترکیب شود و گاهی به انفجار منجر خواهد شد.
این اسید با بسیاری از ترکیبات آلی، به شدت واکنش نشان دهد. از این رو باید دور از مواد آلی واکنشگر و فعال، ذخیره و نگهداری شود.
انبار محل ذخیره مخازن حاوی اسید باید تهویه کامل داشته باشد.
صنایع مرتبط با اسید نیتریک
- به عنوان معرف یا واکنشگر در روشهای آنالیز شامل ICP-MS ، ICP-AES ، GFAA و Flame AA ، از اسید نیتریک رقیق (۰.۵-۵.۰٪) به عنوان یک ترکیب بافت نمونه، برای تعیین مقدار فلزات در محلول استفاده میشود.
- به طور معمول در فرآیند هضم نمونههای آب کدر، نمونههای لجن، نمونههای جامد و همچنین انواع نمونههای منحصر به فرد که به تجزیه با روشهای ICP-MS ، ICP-OES ، ICP-AES ، GFAA و طیف سنجی جذب اتمی شعله نیاز دارند، استفاده میشود. برای هضم نمونه، از محلول ۵۰٪ اسید استفاده میشود.
- در غلظت کم (تقریباً ۱۰٪)، اسید نیتریک اغلب برای کهنهتر شدن چوب کاج و افرا استفاده میشود. این یکی از کاربردها در صنایع چوب و نجاری است.
- از نیترات هیدروژن به عنوان عامل پاک کننده برای برخی از کاربردهای خاص مانند چاپ، حذف ناخالصی فولاد ضد زنگ یا تمیز کردن قطعات سیلیکونی در الکترونیک استفاده میشود.
- از محلول نیتریک اسید، آب و الکل، برای حکاکی رو فلزات استفاده میشود تا ساختار ریز تشکیل شود.
- مخلوط آبی از ۵-۳۰٪ اسید نیتریک و ۱۵-۴۰٪ اسید فسفریک معمولاً برای تمیز کردن مخازن و ظروف مواد غذایی و تجهیزات لبنی، برای از بین بردن رسوبات کلسیم و منیزیم استفاده میشود.
وضعیت بازار و خرید و فروش اسید نیتریک
امکان خرید اینترنتی اسید نیتریک و ثبت سفارش تلفنی برای آن وجود دارد. گرید صنعتی نیتریک اسید و گرید آزمایشگاهی هر کدام در بازار با برندهای ویژهای شناخته میشوند.
قیمت اسید نیتریک در بازار بر اساس قیمت روز مواد شیمیایی، قیمت ارز، هزینههای حمل و نقل و نوع بسته بندی سفارشی، تعیین میشود.
برندهای محبوب اسید نیتریک
در اینجا چند برند محبوب اسید نیتریک آورده شده است:
Merck:
مرک یک شرکت آلمانی علوم زیستی و مواد شیمیایی است که اسید نیتریک با درجه خلوص مختلف را برای کاربردهای آزمایشگاهی و صنعتی ارائه می دهد.
Sigma-Aldrich:
سیگما-آلدریچ یک شرکت شیمیایی و بیوتکنولوژی آمریکایی است که اسید نیتریک را در گریدهای مختلف برای تحقیقات، آزمایشگاه ها و مصارف صنعتی عرضه می کند.
JT Baker:
جی تی بیکر یک شرکت آمریکایی است که مواد شیمیایی آزمایشگاهی و صنعتی از جمله اسید نیتریک را عرضه می کند.
Acros Organics:
اکروس ارگانیکس یک شرکت آمریکایی است که مواد شیمیایی آلی و غیر آلی با کیفیت بالا از جمله اسید نیتریک را ارائه می دهد.
Fisher Scientific:
فیشر ساینتیفیک یک شرکت آمریکایی است که تجهیزات و مواد آزمایشگاهی از جمله اسید نیتریک را عرضه می کند.
این ها فقط چند نمونه هستند و برندهای دیگری نیز در بازار موجود هستند. انتخاب بهترین برند اسید نیتریک به نیازها و کاربردهای خاص شما بستگی دارد.
هنگام انتخاب برند اسید نیتریک، عوامل زیر را در نظر بگیرید:
- خلوص: برای کاربردهای حساس مانند تحقیقات علمی، به اسید نیتریک با درجه خلوص بالا نیاز دارید.
- قیمت: اسید نیتریک می تواند در قیمت ها بسیار متفاوت باشد. بودجه خود را در نظر بگیرید و قیمت ها را از چندین تامین کننده مقایسه کنید.
- حجم: اسید نیتریک در حجم های مختلف از بطری های کوچک تا بشکه های بزرگ موجود است. مقدار مورد نیاز خود را در نظر بگیرید و بر این اساس خرید کنید.
- صدور گواهینامه: اگر برای اسید نیتریک به گواهینامه خاصی نیاز دارید، مطمئن شوید که برندی را انتخاب کنید که بتواند گواهینامه های لازم را ارائه دهد.
- ایمنی: اسید نیتریک یک ماده شیمیایی خطرناک است. همیشه هنگام کار با آن احتیاط کنید و از دستورالعمل های ایمنی سازنده پیروی کنید.
با در نظر گرفتن این عوامل، می توانید بهترین برند اسید نیتریک را برای نیازهای خود انتخاب کنید.
وبسایت تخصصی شیمیکو، بهترین مرجع برای خرید و فروش اسید نیتریک در حجم مورد نیاز است.
 انتشار آگهی خرید و فروش اسید نیتریک
انتشار آگهی خرید و فروش اسید نیتریک
منبع:
آخرین دیده شده ها














 (6 امتیاز)
(6 امتیاز)

دیدگاه کاربران
سلام من بیش از ۵۰ تا بیست لیتری اسید دارم ولی اسم اسیدرا نمیدانم ، ۱۵ سال پیش برای شرکت تولید شیشه و آیینه استفاده میکردیم، زردرنگ و دودسفیددارد ، مقداری روی آهن زنگزده ریختم یک دقیقه بعدسفیدوبراق شد، کسی می دونه چه کاربردی دارد یا میخواد بگه
جدول زمان بندی سمپاشی مرکبات برای باغداران ایرانی
چگونه آفات درختان میوه را کنترل کنیم؟
۲۰ کود ارگانیک خانگی برای گیاهان آپارتمانی
برنامه کوددهی درخت انگور: راهنمای جامع برای تاکستان داران
جدول برنامه کوددهی درخت گردو: راهنمای جامع ماهانه
جدول برنامه کوددهی درخت پسته: راهنمای جامع ماه به ماه
جدول کوددهی درختان میوه در تابستان: راز باغ های پربار
بهترین کود پتاسیم برای درخت زردآلو: راز میوههای طلایی و باغی پربار
کاشت هندوانه بدون مصرف آب؛ معجزه ای در دل کویرهای ایران
جدول زمان سمپاشی درختان میوه: راهنمای جامع برای باغبانی در سال ۱۴۰۴
کود تابستانه درختان: راهنمای جامع انتخاب بهترین کودها برای رشد بهینه
۵ روش علمی و سنتی برای گرفتن تلخی زیتون
گیلسونایت چیست؟ ویژگیها، خواص و کاربرد قیر معدنی
سولفات منیزیم چیست؟ خواص، روش تولید و کاربردهای منیزیم سولفات
همه چیز درباره هیدروکلریک اسید | دسترسی به قیمت روز اسید کلریدریک
همه چیز درباره بنتونیت (bentonite)
همهچیز درباره کود فسفاته دی آمونیوم فسفات| DAP
پرمنگنات پتاسیم | ویژگیها، روش تولید و کاربردهای آن
نمک صنعتی: روش تولید و کاربردهای کلرید سدیم
سود مایع چیست؟ همه چیز درباره سود سوزآور مایع
مونو اتیلن گلایکول| روش تولید، ویژگیها و کاربردهای MEG
همه چیز درباره متانول و ۹ کاربرد اصلی این ماده
سولفات آهن چیست؟ | همه چیز درباره سولفات آهن
نشادر چیست؟ | خواص، کاربردها و بازار خرید و فروش کلرید آمونیوم