سودا اش (سدیم کربنات) چیست؟ ویژگیها، روش تولید و کاربردها

سودا اش (soda ash) یا خاکستر سودا Na2CO3، یا سدیم کربنات (Sodium Carbonate) (که همچنین به عنوان سودا شستشو، سودا اَش و کریستالهای سودا شناخته میشود) یک ترکیب معدنی است که ساختارهای هیدراته آن، مختلف هستند.
همه شکلهای این ترکیب، شامل نمکهای سفید، بی بو و محلول در آب هستند که محلولهای قلیایی متوسطی را در آب تولید میکنند. از نظر تاریخی، این ماده از خاکستر گیاهانی که در خاکهای غنی از سدیم رشد میکردند، استخراج میشد.
فهرست مطالب
نگاهی به تاریخچه سوا اش (کربنات سدیم)
هزاران سال است که انسان ها سودا اش را میشناسند و از آن استفاده می کنند. مصریان باستان این ترکیب را از ماده معدنی به نام ناترون (natron) که در کف دریاچه های خشک یافت می شد، استخراج می کردند. ناترون، ترکیبی از سودا اش و جوش شیرین است.
مصریان از سودا اش در مومیایی کردن اجساد استفاده می کردند. این ترکیب، اجساد مردگان را خشک و از پوسیدگی آنها جلوگیری می کرد. این تکنیک به قدری مؤثر بود که برخی از اجساد مومیایی شده با قدمت بیش از ۳۰۰۰ سال، امروزه در وضعیتی همانند زمان مرگ شان، قرار دارند. در طول قرن ها، سدیم کربنات نیز از احتراق مواد آلی، به ویژه جلبک دریایی تولید می شد. در این روش تولید، این ترکیب رایج، سودا اَش است.
سوزاندن گیاهان مرده مقادیر بسیار زیادی کربنات سدیم تولید نمیکند، بنابراین شیمیدانان آن دوران به دنبال روش های مصنوعی برای تولید این ترکیب مهم بودند. اولین پیشرفت در این جستجو در سال ۱۷۹۱، زمانی رخ داد که شیمیدان فرانسوی نیکلاس لبلانک (۱۷۴۲-۱۸۰۶) روشی را برای تولید سدیم کربنات ابداع کرد که برای نزدیک به یک قرن، به یک استاندارد در صنعت تبدیل شد.
در سال ۱۹۰۰، تقریباً تمام کربنات سدیم تولید شده در جهان توسط فرآیند Solvay ساخته میشد. در ادامه، همین فرآیندها را توضیح میدهیم.

روشهای تولید سودا اش
۱- تولید سدیم کربنات از معدن
ترونا (Trona) که با نام تری سدیم هیدروژن دی کربنات دی هیدرات نیز شناخته می شود، در چندین منطقه از ایالات متحده استخراج می شود و تقریباً تمام مصرف سودا اش این منطقه را تامین میکند. ذخایر طبیعی بزرگ که در سال ۱۹۳۸ یافت شد، مانند ذخایر نزدیک گرین ریور، وایومینگ، استخراج معدن را در مقایسه با تولید صنعتی در آمریکای شمالی، مقرون به صرفه تر کرده است.
ذخایر مهمی از ترونا در ترکیه وجود دارد. دو میلیون تن سودا اش از ذخایر نزدیک آنکارا استخراج شده است. همچنین از برخی دریاچه ها مانند دریاچه ماگادی در کنیا، این ترکیب با عملیات لایروبی استخراج می شود. چشمه های آب گرم، نمک دریاچه را به طور مداوم تولید می کنند، به شرطی که میزان لایروبی، بیشتر از میزان آبگیری چشمه نباشد، منبعی کاملاً پایدار از سدیم کربنات است.
۲- تولید سودا اش از گیاهان و جلبک ها (Barilla و kelp)
چندین گونه گیاهی “هالوفیت” (مقاوم به نمک) و گونههای جلبک دریایی را میتوان برای تولید شکل ناخالص کربنات سدیم فرآوری کرد؛ این منابع تا اوایل قرن نوزدهم در اروپا و مکانهای دیگر، بیشتر مصرف میشدند. گیاهان یا جلبک دریایی، خشک و سوزانده می شدند. سپس خاکسترها، با آب شستشو داده میشد تا یک محلول قلیایی تشکیل شود.
این محلول به صورت خشک، جوشانده میشد تا محصول نهایی تولید گردد که به آن “سودا اَش” می گفتند. «Barilla» یک اصطلاح تجاری است که به فرم ناخالص پتاس به دست آمده از گیاهان ساحلی، یا kelp اطلاق میشود.
۳- فرآیند لبلانک برای تولید کربنات سدیم
در سال ۱۷۹۲، نیکلاس لبلانک، شیمیدان فرانسوی، فرآیندی را برای تولید کربنات سدیم از نمک، اسید سولفوریک، سنگ آهک و زغال سنگ به ثبت رساند. در مرحله اول، کلرید سدیم با اسید سولفوریک در فرآیند مانهایم (Mannheim process) تصفیه میشود. این واکنش به تولید سولفات سدیم (کیک نمک) و کلرید هیدروژن منجر میشود:
2NaCl + H2SO4 → Na2SO4 + 2HCl
کیک نمک و سنگ آهک خرد شده (کربنات کلسیم) تحت حرارت دادن با زغال سنگ، کاهش پیدا می کند. این تبدیل شامل دو بخش است. اول واکنش کربوترمیک است که در آن زغال سنگ، یعنی منبع کربن، سولفات را به سولفید کاهش میدهد:
Na2SO4 + 2C → Na2S + 2CO2
مرحله دوم واکنش، تولید سدیم کربنات و سولفید کلسیم است:
Na2S + CaCO3 → Na2CO3 + CaS
به این مخلوط، خاکستر سیاه می گویند. سودا اَش از خاکستر سیاه، با آب استخراج می شود. از تبخیر این عصاره، سدیم کربنات جامد حاصل میگردد.
اسید کلریدریک تولید شده توسط فرآیند Leblanc منبع اصلی آلودگی هوا بود و محصول جانبی سولفید کلسیم نیز مشکلات دفع زباله را به همراه داشت. با این حال، این روش اصلی تولید کربنات سدیم تا اواخر دهه ۱۸۸۰ به قوت خودش باقی ماند.
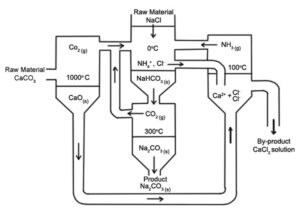
۴- تولید کربنات سدیم در فرآیند Solvay
در سال ۱۸۶۱، شیمیدان بلژیکی، ارنست سولوای (Ernest Solvay)، روشی را برای تولید کربنات سدیم با اولین واکنش کلرید سدیم، آمونیاک، آب و دی اکسید کربن برای تولید بی کربنات سدیم و کلرید آمونیوم ابداع کرد:
NaCl + NH3 + CO2 + H2O → NaHCO3 + NH4Cl
سپس بی کربنات سدیم حاصل، با حرارت دادن به کربنات سدیم تبدیل میشد و آب و دی اکسید کربن آزاد میشدند:
2NaHCO3 → Na2CO3 + H2O + CO2
آمونیاک از محصول جانبی کلرید آمونیوم و با تصفیه آن با آهک (اکسید کلسیم) باقی مانده از تولید دی اکسید کربن، تولید میشد:
2NH4Cl + CaO → 2NH3 + CaCl2 + H2O
فرآیند Solvay، آمونیاک را بازیابی میکند. فقط آب نمک و سنگ آهک در این فرآیند مصرف میشود و کلرید کلسیم، تنها محصول زائد آن است. این فرآیند به طور قابل ملاحظهای مقرون به صرفه تر از فرآیند Leblanc است که دو محصول زائد تولید میکند، یعنی سولفید کلسیم و کلرید هیدروژن.
فرآیند Solvay به سرعت بر تولید کربنات سدیم در سراسر جهان تسلط یافت. تا سال ۱۹۰۰، ۹۰ درصد از این ماده توسط فرآیند Solvay تولید میشد و آخرین کارخانه فرآیند Leblanc در اوایل دهه ۱۹۲۰ بسته شد.
۵- تولید سدیم کربنات در فرآیند هاوز (Hou’s process)
این فرآیند توسط شیمیدان چینی Hou Debang در دهه ۱۹۳۰ توسعه یافت. دی اکسید کربن، محصول جانبی اولیه، از طریق محلول اشباع شده سدیم کلرید و آمونیاک پمپاژ میشد تا با این واکنشها، بی کربنات سدیم تولید شود:
CH4 + 2H2O → CO2 + 4H2
3H2 + N2 → 2NH3
NH3 + CO2 + H2O → NH4HCO3
NH4HCO3 + NaCl → NH4Cl + NaHCO3
جوش شیرین به دلیل حلالیت کم، به عنوان یک رسوب جمع آوری میشود و سپس تا حدود ۸۰ درجه سانتیگراد (۱۷۶ درجه فارنهایت) یا ۹۵ درجه سانتیگراد (۲۰۳ درجه فارنهایت) حرارت داده میشود تا کربنات سدیم خالص مشابه مرحله آخر فرآیند Solvay به دست آید.
کلرید سدیم بیشتری به محلول باقیمانده آمونیوم و کلرید سدیم اضافه میشود. همچنین آمونیاک بیشتری در دمای ۳۰-۴۰ درجه سانتیگراد به این محلول پمپاژ میشود. در ادامه، دمای محلول به زیر ۱۰ درجه سانتیگراد کاهش مییابد. حلالیت کلرید آمونیوم در ۳۰ درجه سانتیگراد بیشتر از کلرید سدیم و در ۱۰ درجه سانتیگراد، کمتر است.
به دلیل این تفاوت حلالیت وابسته به دما و اثر یون مشترک، کلرید آمونیوم در محلول کلرید سدیم رسوب میکند. فرآیند هاوز، اقتصادی تر است چون آمونیاک بیشتری نیاز ندارد و از طرفی، محصول جانبی کلرید آمونیوم را میتوان به عنوان کود فروخت.
خواص کربنات سدیم
خواص و ویژگیهای فیزیکی و شیمیایی این ترکیب جامد پودری موجب کاربردهای بسیار آن در صنایع مختلف است. به طور کامل، در جدول قسمت بعد به این ویژگیها میپردازیم.
مشخصات فیزیکی و شیمیایی سودا اش
| Sodium carbonate سدیم کربنات |
|
| نام ترکیب | |
| نامگذاری آیوپاک سدیم کربنات/Sodium carbonate |
|
| نام پیشنهادی از سوی آیوپاک دی سدیم کربنات/Disodium carbonate |
|
| نام های متداول دیگر سودا اَش؛ سودا شستشو؛ کریستال سودا؛ سدیم تری اوکسوکربنات |
|
| شاخصهای شناساگر | |
| ۴۹۷-۱۹-۸ (بدون آب) 5968-۱۱-۶ (تک آبه) ۶۱۳۲-۰۲-۱ (۱۰ آبه) |
CAS Number |
| ۲۰۷-۸۳۸-۸ | EC Number |
| E500(i) | E number |
| ۱۰۳۴۰ | PubChem CID |
| VZ4050000 | RTECS number |
| ویژگیها و خواص | |
| Na۲CO۳ | فرمول شیمیایی |
| ۱۰۵.۹۸۸۸ g/mol (بدون آب) 286.۱۴۱۶ g/mol (10 آبه) |
جرم مولی |
| جامد سفید رنگ با خاصیت جذب رطوبت | شکل ظاهری |
| بدون بو | بو |
| ۲.۵۴ g/cm۳ (۲۵ °C, بدون آب) 1.۹۲ g/cm۳ (۸۵۶ °C) 2.۲۵ g/cm۳ (تک آبه) 1.۵۱ g/cm۳ (۷ آبه) 1.۴۶ g/cm۳ (۱۰ آبه) |
دانسیته |
| ۸۵۱ °C (1,564 °F; 1,124 K) (بدون آب) 100 °C (212 °F; 373 K) تجزیه می شود (تک آبه) 33.۵ °C (92.3 °F; 306.6 K) تجزیه می شود (۷ آبه) 34 °C (93 °F; 307 K) (۱۰ آبه) |
نقطه ذوب |
| فرم بدون آب, g/100 mL: 7 (۰ °C) 16.۴ (۱۵ °C) 34.۰۷ (۲۷.۸ °C) 48.۶۹ (۳۴.۸ °C) 48.۱ (۴۱.۹ °C) 45.۶۲ (۶۰ °C) 43.۶ (۱۰۰ °C) |
حلالیت در آب |
| محلول در قلیاها و گلیسرول نسبتاً محلول در الکل نا محلول در دی سولفید کربن؛ استون؛ الکیل استات؛ الکل؛ بنزونیتریل؛ آمونیاک مایع |
حلالیت در سایر حلال ها |
| ۹۸.۳ g/100 g (155 °C) | حلالیت در گلیسرین |
| ۳.۴۶ g/100 g (20 °C) | حلالیت در اتان دی اُل |
| ۰.۵ g/kg | حلالیت در دی متیل فرم آلدهید |
| ۱۰.۳۳ | اسیدیته (pKa) |
| ۳.۴ cP (887 °C) | ویسکوزیته |
| ویژگیهای ترموشیمیایی | |
| ۱۱۲.۳ J/mol·K | ظرفیت گرمایی (C) |
| ۱۳۵ J/mol·K | آنتروپی استاندارد مولار (S⦵۲۹۸) |
| −۱۱۳۰.۷ kJ/mol | آنتالپی استاندارد تشکیل (ΔfH⦵۲۹۸) |
| −۱۰۴۴.۴ kJ/mol | انرژی آزاد گیبس (ΔfG⦵) |
| ترکیبات مرتبط | |
| Sodium bicarbonate سدیم بی کربنات |
آنیون ها |
| لیتیوم کربنات/Lithium carbonate پتاسیم کربنات/Potassium carbonate روبیدیوم کربنات/Rubidium carbonate سزیوم کربنات/Caesium carbonate |
کاتیون ها |
| سدیم سسکوئی کربنات/Sodium sesquicarbonate سدیم پر کربنات/Sodium percarbonate |
سایر ترکیبات مرتبط |
کاربردهای سودا اش
۱- صنعت ساخت شیشه
Sodium carbonate به عنوان یک شار برای سیلیس (2SiO، با نقطه ذوب ۱۷۱۳ درجه سانتیگراد) عمل میکند و نقطه ذوب مخلوط را به حدی میرساند که بدون نیاز به مواد خاص، قابل دستیابی است. این “ترکیب سودا” به آرامی در آب حل میشود.
بنابراین مقداری کربنات کلسیم به مخلوط مذاب اضافه میشود تا شیشه، نامحلول باشد. شیشههای انواع بطری و پنجره از ذوب چنین مخلوطهایی از سدیم کربنات، کربنات کلسیم و ماسه سیلیس و دی اکسید سیلیکون ساخته میشوند.
۲- به عنوان نرم کننده آب
آب سخت حاوی ترکیبات محلول، معمولاً ترکیبات کلسیم یا منیزیم است. کربنات سدیم برای از بین بردن سختی موقت و دائمی آب استفاده میشود. از آنجایی که این ماده، محلول در آب است و کربنات منیزیم و کربنات کلسیم نامحلول هستند. برای نرم کردن آب با حذف ۲+ Mg و ۲+ Ca استفاده میشود.
این یونها پس از تیمار با یونهای کربنات، رسوبات جامد نامحلول را تشکیل میدهند. آب نرم میشود، زیرا حاوی یونهای کلسیم و یون منیزیم محلول نیست.
۳- افزودنی غذا و پخت و پز
کربنات سدیم کاربردهای مختلفی در آشپزی دارد، عمدتاً به این دلیل که باز قویتری نسبت به جوش شیرین است اما ضعیفتر از قلیای هیدروکسید فلزی میباشد (که ممکن است به هیدروکسید سدیم یا به هیدروکسید پتاسیم اشاره داشته باشد). قلیاییت، بر تولید گلوتن در خمیرهای ورز داده شده تأثیر می گذارد. محلولی از نمکهای قلیایی از این ترکیب برای طعم دادن به رشته فرنگی ژاپنی استفاده میشود.
نانوایان به طور مشابه از سودا اش به عنوان جایگزینی برای آب شیرین استفاده میکنند تا در کیکهای آنها، بافت خاص را ایجاد کند و قهوهای شدن کیک را بهبود ببخشد.
از این ماده در تولید پودر شربت استفاده میشود. احساس سرد بودن و سوزنی شدن دهان، ناشی از واکنش گرماگیر بین کربنات سدیم و اسید ضعیف، معمولاً اسید سیتریک است که گاز دی اکسید کربن آزاد میکنند، و زمانی رخ میدهد که شربت توسط بزاق دهان، مرطوب میشود.
این ماده همچنین در صنایع غذایی به عنوان یک افزودنی غذایی (کد E500) به عنوان تنظیم کننده اسیدیته، عامل ضد انعقاد، عامل حجم دهنده و تثبیت کننده استفاده میشود.
۴- سایر کاربردها سودا اش
- این ماده به عنوان یک باز نسبتا قوی در صنایع مختلف استفاده میشود. به عنوان یک ماده قلیایی معمولی، در بسیاری از فرآیندهای شیمیایی ترجیح داده میشود، زیرا ارزان تر از هیدروکسید سدیم است و حمل و نقل آن بسیار ایمنتر است. به ویژه ملایم بودن قلیاییت این ترکیب، استفاده از آن را در مصارف خانگی توصیه میکند.
- از سدیم کربنات به عنوان یک تنظیم کننده pH برای حفظ شرایط قلیایی پایدار برای تولید فیلم عکاسی استفاده میشود.
- سودا اش یک افزودنی رایج در استخرهای شنا و آب آکواریوم برای حفظ pH مطلوب و سختی کربناته (KH) است.
- کربنات سدیم در رنگرزی با رنگهای مخصوص الیاف، برای اطمینان از پیوند شیمیایی مناسب رنگ با الیاف سلولزی (گیاهی) و معمولاً قبل از رنگآمیزی استفاده میشود.
- علاوه بر CaO و سایر ترکیبات بازی ملایم، سدیم کربنات در فرآیند فلوتاسیون کف، برای حفظ pH مطلوب به عنوان یک نرم کننده شناور استفاده میشود.

ایمنی سودا اش
- این ماده غیر قابل اشتعال است.
- دمای خوداشتعالی ترکیب در دسترس نیست.
- نقاط اشتعال پذیری سدیم کربنات در دسترس نیست.
- محدودیتهای قابل اشتعال، در دسترس نیست.
- هنگامی که سدیم کربنات حرارت داده میشود تا تجزیه شود، دود Na2O منتشر میکند.
- خطرات آتش سوزی در حضور مواد مختلف در دسترس نیست.
- خطرات انفجار در حضور مواد مختلف در دسترس نیست.
- کربنات سدیم در تماس با فلورید می تواند مشتعل شود و به شدت بسوزد.
- سودا اش در تماس با فلورین در دمای معمولی در اثر تابش، تجزیه میشود.
- سودا اش با فلز آلومینیوم داغ، واکنش انفجاری میدهد.
- این ترکیب، پایدار است.
- دمای ناپایداری، در دسترس نیست.
- شرایط ناپایداری آن در حضور مواد ناسازگار مانند اسیدها و رطوبت است.
- این ماده با پنتوکسید فسفر، لیتیوم، فلورین، فلوئورید، آمونیاک + نیترات نقره، ۶،۴،۲-تری نیتروتولوئن، آمونیاک، اسیدها، سولفید سدیم + آب، پراکسید هیدروژن، آلومینیوم فلزی قرمز گداخته، سولفید سدیم، روی، کلسیم هیدروکسید ناسازگار است.
- کربنات سدیم در حضور اسیدها با ایجاد جوش، تجزیه میشود.
- محلولهای غلیظ داغ سدیم کربنات، خاصیت خورندگی ملایم برای فولاد دارند.
- پلیمریزاسیون در این ماده اتفاق نمیافتد.
ذخیره و نگهداری سودا اش:
هنگام کار با این ترکیب، گرد و غبار آن را تنفس نکنید. لباس محافظ مناسب بپوشید. تجهیزات تنفسی مناسب و ماسک و عینک و دستکش داشته باشید. از تماس ترکیب شیمیایی با پوست و چشمها جلوگیری کنید.
بستهبندیهای سدیم کربنات را باید دور از مواد ناسازگار مانند اسیدها نگهداری کنید. مواد را در ظرف درب بسته نگه دارید. ظرفها و کیسهها را در مکانی خنک و دارای تهویه مناسب نگهداری کنید. این ترکیب نباید در دماهای بالا ذخیره شود؛ بهترین دما، ۲۴ درجه سانتی گراد است.
بسته بندی کربنات سدیم
بستهبندی کربنات سدیم سبک و سدیم کربنات سنگین در کیسههای مقاوم و محکم با وزن ۵۰ کیلوگرمی در بازار موجود است. برای ثبت سفارشهای عمده، کیسههای جانبوبگ هم در دسترس میباشند که در وزن ۱۰۰۰ کیلوگرمی به مشتری ارائه میشوند.
بیشتر بخوانید: کربنات سدیم چیست؟ همه چیز درباره کربنات سدیم

خرید و فروش و قیمت کربنات سدیم
کربنات سدیم به صورت پودر و گرانول در بازار عرضه میشود. این ماده در کیسههای ۲۵ کیلوگرمی و جامبو بگهای ۱۰۰۰ کیلوگرمی به فروش میرسد.
قیمت کربنات سدیم:
قیمت کربنات سدیم به کیفیت، نوع و میزان سفارش بستگی دارد. قیمت این ماده در سال ۱۴۰۲ بین ۲۰,۰۰۰ تومان تا ۳۰,۰۰۰ تومان به ازای هر کیلوگرم است.
برندهای معتبر کربنات سدیم (سودا اش) در ایران
با توجه به کاربردهای گسترده ترکیب سودا اش در صنایع کوچک و بزرگ، تقاضا برای خرید و فروش این ماده مهم صنعتی، قابل توجه است. میتوانید برای خرید سودا اش (کربنات سدیم) از برندهای زیر:
- گروه صنعتی کاوه سودا
- کربنات سدیم سمنان
- سودا اش فیروزآباد
- کربنات سدیم ازبک
- کربنات سدیم مراغه
برندهای معتبر کربنات سدیم در ایران:
۱. گروه صنعتی کاوه سودا:
- یکی از بزرگترین تولیدکنندگان کربنات سدیم در ایران
- تولیدکننده انواع کربنات سدیم سبک و سنگین
- دارای گواهینامههای ISO 9001 و ISO 14001
- سابقه طولانی در صادرات به کشورهای مختلف
۲. کربنات سدیم سمنان:
- از دیگر تولیدکنندگان بزرگ کربنات سدیم در ایران
- تولیدکننده کربنات سدیم با کیفیت بالا
- دارای گواهینامههای ISO 9001 و ISO 14001
- سابقه طولانی در صادرات به کشورهای مختلف
۳. سودا اش فیروزآباد:
- تولیدکننده کربنات سدیم با کیفیت مناسب
- قیمت رقابتی
- سابقه طولانی در فعالیت در صنعت
۴. کربنات سدیم ازبک:
- از برندهای معروف و باکیفیت در بازار
- تولیدکننده کربنات سدیم با خلوص بالا
- مناسب برای مصارف صنعتی خاص
۵. کربنات سدیم مراغه:
- از برندهای شناخته شده در بازار
- قیمت مناسب
- کیفیت قابل قبول
نکاتی در خصوص انتخاب برند کربنات سدیم:
- کیفیت: اولین و مهمترین فاکتور در انتخاب برند کربنات سدیم، کیفیت آن است.
- کاربرد: نوع کاربرد کربنات سدیم در انتخاب برند آن تاثیرگذار است.
- قیمت: قیمت برندهای مختلف کربنات سدیم با یکدیگر متفاوت است.
- سابقه و اعتبار: سابقه و اعتبار برند در انتخاب آن حائز اهمیت است.
علاوه بر برندهای ذکر شده، برندهای دیگری نیز در بازار وجود دارند که میتوانید با توجه به نیاز و شرایط خود، آنها را بررسی و انتخاب کنید.
و سایر کارخانههای پتروشیمی و یا سودا اش خارجی به لیست محصولات شیمیکو مراجعه کنید.
 انتشار آگهی خرید و فروش سودا اش
انتشار آگهی خرید و فروش سودا اش
منابع:
https://westliberty.edu/health-and-safety/files/2012/08/Sodium-Carbonate.pdf
آخرین دیده شده ها
















دیدگاه کاربران
راهنمای جامع تبدیل انگور به کشمش با مواد شیمیایی: تولید کشمش صادراتی
بهترین زمان مصرف کود پتاس برای برنج: راهنمای جامع برای شالیزارها
جدول زمان بندی سمپاشی مرکبات برای باغداران ایرانی
جدول آفات درختان میوه + روش های کنترل
۲۰ کود ارگانیک خانگی برای گیاهان آپارتمانی
برنامه کوددهی درخت انگور: راهنمای جامع برای تاکستان داران
جدول برنامه کوددهی درخت گردو: راهنمای جامع ماهانه
جدول برنامه کوددهی درخت پسته: راهنمای جامع ماه به ماه
جدول کوددهی درختان میوه در تابستان: راز باغ های پربار
بهترین کود پتاسیم برای درخت زردآلو: راز میوههای طلایی و باغی پربار
کاشت هندوانه بدون مصرف آب؛ معجزه ای در دل کویرهای ایران
جدول زمان سمپاشی درختان میوه: راهنمای جامع برای باغبانی در سال ۱۴۰۴
گیلسونایت چیست؟ ویژگیها، خواص و کاربرد قیر معدنی
سولفات منیزیم چیست؟ خواص، روش تولید و کاربردهای منیزیم سولفات
همه چیز درباره هیدروکلریک اسید | دسترسی به قیمت روز اسید کلریدریک
همه چیز درباره بنتونیت (bentonite)
همهچیز درباره کود فسفاته دی آمونیوم فسفات| DAP
پرمنگنات پتاسیم | ویژگیها، روش تولید و کاربردهای آن
نمک صنعتی: روش تولید و کاربردهای کلرید سدیم
سود مایع چیست؟ همه چیز درباره سود سوزآور مایع
مونو اتیلن گلایکول| روش تولید، ویژگیها و کاربردهای MEG
همه چیز درباره متانول و ۹ کاربرد اصلی این ماده
سولفات آهن چیست؟ | همه چیز درباره سولفات آهن
نشادر چیست؟ | خواص، کاربردها و بازار خرید و فروش کلرید آمونیوم