کلرین | ویژگیها، روش تولید و کاربرد کلر

کلر یا کلرین (Chlorine) یک عنصر شیمیایی با نماد Cl و عدد اتمی ۱۷ است. این عنصر، دومین هالوژن سبک است و بین فلورین (F) و برم (Br) در جدول تناوبی ظاهر میشود و خواص آن معمولی است. کلرین گازی در دمای اتاق به رنگ زرد و یا سبز است. این، یک عنصر فوق العاده واکنش پذیر و یک عامل اکسید کننده قوی میباشد. در میان عناصر، بالاترین میل الکترونگیری را دارد.
رایجترین ترکیب کلر، کلرید سدیم (نمک معمولی)، از دوران باستان شناخته شده است. حدود سال ۱۶۳۰، گاز کلرین برای اولین بار در یک واکنش شیمیایی سنتز شد، اما به عنوان یک ماده اساسی و مهم شناخته نشد. “کارل ویلهلم شیله” توصیفی برای این گاز در سال ۱۷۷۴ نوشت؛ با فرض اینکه این ماده اکسید کننده، یک عنصر جدید است.
در سال ۱۸۰۹، شیمیدانان پیشنهاد کردند که این گاز ممکن است یک عنصر خالص باشد و این نظریه توسط “سِر همفری دیوی” در سال ۱۸۱۰ تأیید شد.
کلر موجود در پوسته زمین به دلیل واکنش پذیری زیاد، به صورت ترکیبات یونی “کلرید” است که شامل نمک طعام است. این ترکیب، دومین هالوژن فراوان (بعد از فلورین) و بیست و یکمین عنصر شیمیایی فراوان در پوسته زمین است.
این ماده به صورت ابتدایی، عمدتاً در فرآیند کلر- آکالی از آب نمک توسط روش الکترولیز تولید میشود. پتانسیل بالای اکسیداسیون آن منجر به تولید محلولهای سفید کننده و ضد عفونی کننده تجاری و معروف در بسیاری از فرآیندهای صنایع شیمیایی شده است.
از این ماده در ساخت طیف گستردهای از محصولات مصرفی استفاده میشود. حدود دو سوم آنها مواد شیمیایی آلی مانند پلی وینیل کلراید (PVC)، بسیاری از واسطههای تولید پلاستیک و .. هستند. به عنوان یک ضدعفونی کننده متداول، از کلرین و ترکیبات حاوی کلر مستقیماً در استخرها استفاده میشود تا شرایط بهداشتی استخر حفظ شود.
این ترکیب با غلظت بالا برای اکثر موجودات زنده بسیار خطرناک و سمی است. از آن به عنوان یک ماده شیمیایی برای جنگ در جنگ جهانی اول برای اولین بار به عنوان “سلاح گاز سمی” استفاده شد.
این ماده به شکل یونهای کلرید برای همه گونههای شناخته شده زنده، ضروری است. انواع دیگر ترکیبات آن در موجودات زنده، نادر است و مواد آلی حاوی این عنصر، تولید شده به روش مصنوعی کم خطر یا سمی هستند.
فهرست مطالب
نگاهی به تاریخچه کلر (کلرین)
کلر عنصری است که احتمالاً اولین بار در حدود سال ۱۲۰۰ با کشف آبزیان و توانایی آن در حل کردن طلا جداسازی شد؛ زیرا این گاز، یکی از محصولات این واکنش است. در حدود سال ۱۶۳۰، این ترکیب به عنوان یک گاز توسط شیمی دان و پزشک فنلاندی “جان باپتیست ون هلمونت” شناخته شد.
این عنصر برای اولین بار در سال ۱۷۷۴ توسط کارل ویلهلم شیله، شیمیدان سوئدی به طور دقیق مورد مطالعه قرار گرفت و این کشف به نام او ثبت شده است:
4HCl + MnO2 → MnCl2 +2 H2O + Cl2
این دانشمند، چندین خاصیت کلر را مشاهده کرد: اثر سفید کنندگی، اثر کشند بودن بر روی حشرات، رنگ زرد مایل به سبز و بویی شبیه به بوی آبزیان.
در سال ۱۸۰۹، “جوزف لوئیس گیلوساک” و “لوئیس ژاک تنارد” با واکنش دادن آن با زغال چوب سعی در تجزیه اسید موریاتیک آزاد کردن عنصر آزاد muriaticum و دی اکسید کربن داشتند. آنها موفق به این جداسازی نشدند.
در سال ۱۸۱۰، “سِر همفری دیوی” مجدداً همان آزمایش را انجام داد و نتیجه گرفت که این ماده یک عنصر است و نه یک ترکیب. در آن زمان، او نام این عنصر جدید را با توجه به رنگ آن، “کلر” گذاشت. در سال ۱۸۲۳، “مایکل فارادی” برای اولین بار، کلر را به مایع تبدیل کرد.
گاز کلر برای اولین بار توسط “کلود برتولت”، شیمیدان فرانسوی برای سفید کردن منسوجات در سال ۱۷۸۵ استفاده شد. اولین بار در سال ۱۷۸۹، ترکیبات سفید کننده جدید شامل هیپوکلریت سدیم، با عبور گاز کلر از محلول کربنات سدیم تولید شد. مایع حاصل معروف به آب ژاول، محلول ضعیف هیپوکلریت سدیم بود.
در اواخر قرن نوزدهم، E. S. Smith برای تولید هیدروکسید سدیم و گاز کلر، یک روش تولید هیپوکلریت سدیم را ابداع کرد. این فرآیند کلر-آلکالی شناخته میشود و اولین بار در مقیاس صنعتی در سال ۱۸۹۲ معرفی شد و اکنون منبع مهمی برای تولید عناصر کلر و سدیم هیدروکسید میباشد.
روشهای تولید کلرین
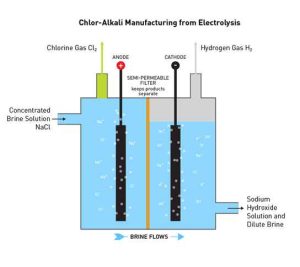
فرایند کلر آلکالیاین ماده، بیش از حد واکنش پذیر است و به عنوان عنصر آزاد در طبیعت وجود ندارد اما به شکل نمکهای کلرید، بسیار فراوان است. این عنصر، یکی از عناصر فراوان در پوسته زمین است. ذخایر بسیاری از مواد معدنی حاوی کلریدها، نظیر کلرید سدیم، شامل این عنصر مهم هستند.
در صنعت، کلر معمولاً از الکترولیز کلرید سدیم محلول در آب تولید میشود. این روش، فرآیند کلر-الکالی نام دارد که در سال ۱۸۹۲، صنعتی شد و اکنون بیشترین گاز کلر صنعتی را تأمین میکند. همراه با کلر، از این روش، گاز هیدروژن و هیدروکسید سدیم حاصل میشود که با ارزشترین محصول است.
2NaCl +2 H2O → Cl2 + H2+2NaOH
الکترولیز محلولهای کلرید همه مطابق با معادلات زیر پیش میروند:
کاتد:
−2H2O +2e− → H2 +2OH
آند:
−2Cl− → Cl2 +2e
الکترولیز سلول غشایی از غشای نفوذپذیر به عنوان یک مبدل یونی استفاده میکند. محلول کلرید سدیم (یا پتاسیم) اشباع شده از محفظه آند عبور کرده و در غلظت کمتر، باقی میماند. این روش همچنین هیدروکسید سدیم (یا پتاسیم) بسیار خالص تولید میکند؛ اما این ضرر را دارد که در غلظتهای بالا به نمک خیلی خالص نیاز خواهد بود.
در فرآیند Deacon، کلرید هیدروژن، در واکنش تولید ترکیبات ارگانو کلر به صورت کلر، بازیابی میشود. این فرآیند به اکسیداسیون با استفاده از اکسیژن وابسته است:
4HCl + O۲ →2Cl2 +2H2O
این واکنش به کاتالیزور نیاز دارد. همانطور که Deacon معرفی کرد، کاتالیزورهای اولیه بر پایه مس ساخته شده بودند. در فرآیندهای تجاری، کاتالیزورهای مبتنی بر کروم و روتنیم استفاده میشوند.
خواص و کاربردهای کلرین
این عنصر، دومین هالوژن است که در گروه ۱۷ جدول تناوبی قرار دارد. از این رو خواص آن شبیه فلوئور، برم و ید است. کلرین، یک عامل اکسید کننده قوی است و برای تکمیل پوسته خارجی الکترونی خود با عناصر زیادی واکنش نشان میدهد.
این عنصر، همچنین یک ماده اکسید کننده ضعیفتری نسبت به فلوئور اما قویتر از برم است.
کلر جامد (پودر کلر) مانند برم و ید جامد، در سیستم بلورهای ارتورومبیک یا orthorhombic، در یک شبکه لایهای از مولکولهای Cl2 متبلور میشود. کلرین از نظر واکنش پذیری، بین فلورین و برم است و یکی از واکنش دهندهترین عناصر است.
سادهترین ترکیب کلر، کلرید هیدروژن، HCl ، یک ماده شیمیایی مهم در صنعت و همچنین در آزمایشگاه است.
ترکیبات پلی کلر چیست؟
اگرچه کلرین، یک ماده اکسید کننده قوی با انرژی اول یونیزاسیون با مقدار بالاتر است، اما ممکن است تحت شرایط شدید اکسید شود و Cl+ را تشکیل دهد. این ترکیبات به ترتیب، دی کلره، تری کلره و تترا کلره میباشند که شرایط واکنشها خاص است.
مشخصات فیزیکی و شیمیایی کلر
- رنگ کلر: زرد مایل به سبز
- شکل ظاهری: گازی – مایع
- نقطه ذوب: ۵/۱۰۱ – درجه سانتی گراد
- نقطه جوش: ۰۴/۳۴ – درجه سانتی گراد
- دانسیته: ۲/۳ گرم بر لیتر
- حالتهای اکسیداسیون: ۱- ؛ ۱+ ؛ ۲+ ؛ ۳+ ؛ ۴+ ؛ ۵+ ؛ ۶+ ؛ ۷+
کاربردهای کلرین
این ماده به صورت پودر کلر یا قرص کلر مورد استفاده قرار میگیرد. کلرید سدیم، متداولترین ترکیب این ماده است و منبع اصلی کلر برای مصرف در صنایع شیمیایی است. حدود ۱۵۰۰۰ ترکیب حاوی کلر به صورت تجاری مورد مصرف قرار میگیرند؛ از جمله ترکیبات متنوعی مانند متان کلر، اتانها، وینیل کلرید، پلی وینیل کلراید (PVC)، تری کلرید آلومینیوم، کلریدهای منیزیم، تیتانیوم، زیرکونیوم و هافنیم که پیش ماده آنها هستند.

قرص کلراز نظر کمی، از تمام حجم کلر تولید شده، حدود ۶۳٪ در ساخت ترکیبات آلی و ۱۸٪ در ساخت ترکیبات کلردار غیر آلی استفاده میشود. حدود ۱۵۰۰۰ ترکیب کلردار به صورت تجاری استفاده میشود. ۱۹٪ باقیمانده کلر تولید شده برای سفید کنندهها و محصولات ضد عفونی کننده استفاده میشود.
۱-کاربرد کلر در تولید شویندهها:
شوینده هایی نظیر هیپو کلریت سدیم با استفاده از کلر تهیه می شوند.
۲-کاربرد در تولید محصولات ضد عفونی کننده:
یکی از کاربردهای ضد عفونی کنندگی این ماده، استفاده از آن برای استخرهای شنا و استخرهای تصفیه آب در صنایع است. پرکلرین، ترکیبی است که حاوی کلر بوده و برای این هدف به کار می رود.
۳-کاربرد در تهیه پلیمرها و ترکیبات آلی کلر دار:
مهمترین ترکیبات آلی از نظر حجم تولید، ۱،۲-دی کلرو اتان و وینیل کلراید، واسطههای تولید PVC هستند. سایر ارگانو کلرین های مهم دیگر شامل متیل کلراید، متیلن کلراید، کلروفرم، وینیلیدین کلراید، تری کلرواتیلن، پرکلرواتیلن، آلیل کلرید، اپی کلرهیدرین، کلروبنزن، دی کلروبنزن ها و تری کلروبنزن ها هستند.
۴-کاربرد در تهیه نمکهای صنعتی:
کلر برای تهیه نمک صنعتی کلرید کلسیم به کار میرود که در صنعت حفاری، بسیار کاربرد دارد. همچنین نمک کلرید پتاسیم، یک کود کشاورزی است که حاوی این عنصر است. عمده ترکیبات معدنی کلر دار شامل موارد زیر هستند:
HCl, Cl2O, HOCl, NaClO3, AlCl3, SiCl4, SnCl4, PCl3, PCl5, POCl3, AsCl3, SbCl3, SbCl5, BiCl3, S2Cl2, SCl2, SOCI2, ClF3, ICl, ICl3, TiCl3, TiCl4, MoCl5, FeCl3, ZnCl2
نقش بیولوژیکی کلرین چیست؟
آنیون کلرید یک ماده مغذی ضروری برای متابولیسم است. کلر برای تولید اسید کلریدریک در معده و عملکرد پمپ سلولی مورد نیاز است. این ترکیب، منبع اصلی نمک طعام یا کلرید سدیم است. غلظت بیش از حد کم یا زیاد کلرید در خون، نمونههایی از اختلالات الکترولیت محسوب میشود.
کاهش کلرید خون منجر به کم آبی بدن میشود. علائم آن اغلب در اثر کمبود آب سریع بدن ایجاد میشود که منجر به آدم مغزی خواهد شد.
ایمنی کلر
کلر یک گاز سمی است که به سیستم تنفسی، چشم و پوست حمله میکند. از آنجا که این گاز، چگالتر از هوا است، تمایل دارد در قسمتهای پایینتر در محیطهایی با تهویه نامناسب، تجمع پیدا کند. گاز کلر یک اکسید کننده قوی است که ممکن است با مواد قابل اشتعال واکنش نشان دهد.
واکنش کلر با آب هنگامی که در سطوح مشخص برای ضد عفونی آب استفاده شود، نگرانی عمدهای برای سلامتی انسان نیست. سایر مواد موجود در آب ممکن است محصولات جانبی ضد عفونی کننده ایجاد کنند که با تأثیرات منفی بر سلامتی انسان همراه هستند.

شرایط نگهداری کلر
گاز منتشر شده از مخازن حاوی این ترکیب را استنشاق نکنید. از تماس با پوست، چشم یا لباس خودداری کنید. شستشوی چشم در صورت تماس با کلرین، ضروری است.
هنگام دست زدن به سیلندرهای گاز، از دستکش ایمنی چرمی و کفش ایمنی استفاده کنید. از سیلندرها در برابر آسیب فیزیکی، کشیدن رو سطوح، غلتاندن لغزش یا رها کردن، محافظت کنید.
هنگام حرکت سیلندرها، همیشه سر جای خود محکم بایستید. هرگز سیلندر را با کلاهک آن بلند نکنید. هنگام جابجایی سیلندرها، حتی برای مسافتهای کوتاه از دریچه آن محافظت کنید. برای حمل و نقل سیلندر باید از یک گاری ( یا چرخ دستی) استفاده کنید.
هرگز جسم خارجی را وارد درپوش سیلندر نکنید (مثلاً آچار، پیچ گوشتی و …). با این کار ممکن است سوپاپ، آسیب دیده و نشتی ایجاد کند.
بعد از هر بار استفاده، شیر ظرف را ببندید. هرگز شعله یا گرمای موضعی را مستقیماً به سیلندرها وارد نکنید. دمای بالا ممکن است به ظرف آسیب برساند و باعث خسارتهایی شود.
سیلندرهای حاوی گاز کلرین باید در جایی نگهداری شود که دما از ۱۲۵ درجه فارنهایت (۵۲ درجه سانتیگراد) بیشتر نباشد. هیچ منبع احتراق نباید در انبارها وجود داشته باشد.
کدها و الزامات ایمنی و محافظت در برابر آتش سوزی احتمالی، آسیب یا انفجار را در انبار باید درج کنید.
همیشه ظروف را به حالت ایستاده و ایمن نگه دارید تا از زمین خوردن یا رها شدن آنها جلوگیری شود. هرگز روی سیستم تحت فشار کار نکنید.
ذخیره سیلندرها و استفاده از ترکیب باید در انبارهایی با تهویه مناسب و قوی انجام گیرد. در صورت بروز نشتی، شیر ظرف را ببندید و مطابق با کلیه موارد ایمنی بین المللی عمل کنید.
سیلندر حاوی گاز کلر نباید در نزدیکی مواد و ترکیبات آلی مانند تینر، بنزین، گازوئیل و… قرار بگیرد، زیرا منجر به انفجار می شود. حتی محیط انبار نیز نباید آغشته به مواد آلی باشد.
بسته بندی کلر
کلر تولید شده در سیلندرهایی با اندازههای مختلف از ۴۵۰ گرم تا ۷۰ کیلوگرم یا تانکرها و مخازن برای حمل و نقل جادهای یا ریلی نگهداری و بسته بندی میشود.
وضعیت بازار و خرید و فروش کلر
خرید کلر مایع یا خرید سیلندرهای حاوی گاز کلر برای مصارف صنعتی در حال حاضر، بازار خوبی دارد. فروش کلرین با درصد خلوص ۷۰%، خرید کلر پارس با مقیاس صنعتی هم از طریق سفارش اینترنتی و هم به صورت خرید در بورس کالا امکان پذیر است. اگر میخواهید این ماده اولیه را از بورس بخرید باید به اطلاعیههای عرضه اولیه کلر در بورس توجه کنید.
منابع:
آخرین دیده شده ها
















دیدگاه کاربران
چگونه آفات درختان میوه را کنترل کنیم؟
۲۰ کود ارگانیک خانگی برای گیاهان آپارتمانی
برنامه کوددهی درخت انگور: راهنمای جامع برای تاکستان داران
جدول برنامه کوددهی درخت گردو: راهنمای جامع ماهانه
جدول برنامه کوددهی درخت پسته: راهنمای جامع ماه به ماه
جدول کوددهی درختان میوه در تابستان: راز باغ های پربار
بهترین کود پتاسیم برای درخت زردآلو: راز میوههای طلایی و باغی پربار
کاشت هندوانه بدون مصرف آب؛ معجزه ای در دل کویرهای ایران
جدول زمان سمپاشی درختان میوه: راهنمای جامع برای باغبانی در سال ۱۴۰۴
کود تابستانه درختان: راهنمای جامع انتخاب بهترین کودها برای رشد بهینه
۵ روش علمی و سنتی برای گرفتن تلخی زیتون
گرما زدگی در گیاهان و درختان: راهنمای جامع پیشگیری و درمان تنش گرمایی
گیلسونایت چیست؟ ویژگیها، خواص و کاربرد قیر معدنی
سولفات منیزیم چیست؟ خواص، روش تولید و کاربردهای منیزیم سولفات
همه چیز درباره هیدروکلریک اسید | دسترسی به قیمت روز اسید کلریدریک
همه چیز درباره بنتونیت (bentonite)
همهچیز درباره کود فسفاته دی آمونیوم فسفات| DAP
پرمنگنات پتاسیم | ویژگیها، روش تولید و کاربردهای آن
نمک صنعتی: روش تولید و کاربردهای کلرید سدیم
سود مایع چیست؟ همه چیز درباره سود سوزآور مایع
مونو اتیلن گلایکول| روش تولید، ویژگیها و کاربردهای MEG
همه چیز درباره متانول و ۹ کاربرد اصلی این ماده
سولفات آهن چیست؟ | همه چیز درباره سولفات آهن
نشادر چیست؟ | خواص، کاربردها و بازار خرید و فروش کلرید آمونیوم